Original
Caracterización morfométrica y química de partículas óseas utilizadas en regeneración ósea guiada
Morphometric and chemical characterization of bone grafting particles used in guided bone regeneration
Actual. Med. 2020; 105: (809): 12-17 DOI: 10.15568/am.2020.809.or01
Enviado: 13-03-2020
Revisado: 18-04-2020
Aceptado: 26-04-2020
RESUMEN
Objetivos: Realizar un análisis morfométrico y químico de distintas partículas óseas de relleno utilizadas para tratamientos de regeneración ósea guiada en odontología.
Métodos: Se analizaron distintas partículas óseas comerciales de origen alogénico (OS, UNC y MO), xenogénico (BO) y aloplástico (GP). Se utilizó como control tejido óseo obtenido de cirugía de dientes retenidos. Para el análisis morfométrico se analizaron las partículas óseas con lupa estereoscópica y se determinó el tamaño medio de las mismas. En el análisis químico se utilizó el microanálisis por energía dispersiva de rayos X (EPXMA). Para ello las muestras fueron criodesecadas, recubiertas en carbón y analizadas en un microscopio electrónico de barrido con el fin de determinar en forma cuantitativa (mmol/kg) los elementos de Ca y P. Asimismo, se determinó la relación Ca/P de cada grupo experimental.
Resultados: El análisis morfométrico mostró que los tamaños medios de partículas óseas (mm) en orden creciente fue: UNC: 0,45; OS: 0,48; BO: 0,65; GP: 0,76; MO: 0,88. Cuando realizamos el análisis microanalítico observamos que todas las partículas óseas de relleno poseían una concentración de Ca menor al control.
Por otra parte, MO presentó una concentración de P estadísticamente superior con respecto a las demás partículas óseas y al control. La relación Ca/P mostró ser estadísticamente menor en MO con respecto a los demás grupos experimentales.
Conclusiones: La caracterización morfológica y química de las partículas óseas de relleno permitió conocer con mayor precisión el tamaño de las partículas óseas así como la concentración de Ca y P presente en las mismas, datos que utilizados junto a otras valoraciones clínicas permitiría obtener un tratamiento de regeneración ósea guiada más efectivo en odontología.
Palabras clave: Partículas óseas de relleno; Microanálisis; Regeneración ósea guiada
ABSTRACT
Purpose: To perform a morphometric and chemical analysis of different bone graft materials used for guided bone regeneration treatments in dentistry.
Methods: allogenic bone graft (OS, UNC and MO), xenogenic bone graft (BO) and alloplastic bone graft (GP), were analyzed. The bone tissue obtained from retained teeth surgery was used as a control. The morphometric analysis of particles was performed by using a stereoscopic magnifying glass and the average particle size was determined. Besides, X-ray dispersive energy microanalysis (EPXMA) was used in the chemical analysis. Bone graft particles were freeze dried, coated with carbon and analyzed in a scanning electron microscope in order to quantitatively determine (mmol/kg) the elements Ca and P. Ca/P ratio was determined for each experimental group.
Results: Morphometric analysis showed that the mean bone particle size (mm) in increasing order was: UNC: 0.45; OS: 0.48; BO: 0.65; GP: 0.76; MO: 0.88. Microanalytical analysis showed that the Ca concentration in different experimental groups is less than the control. On the other hand, MO presented a statistically higher concentration of P than the other particles and the control. Ca/P ratio was statistically lower in MO compared to the other experimental groups.
Conclusions: The morphological and chemical characterization of the bone particles allowed to know with greater precision the particle size, as well as the concentration of Ca and P present in them, data that should be used together with other clinical evaluations for guided bone regeneration treatments in dentistry.
Keywords: Bone grafting particle; Microanalysis; Guided bone regeneration.
Leer Artículo Completo
INTRODUCCIÓN
Cuando se realiza una exodoncia, en el hueso alveolar se produce una disminución de volumen que se caracteriza por cambios dimensionales en sentido vertical y horizontal, los cuales se desarrollan principalmente en los primeros 3 meses (1,2). En vista a estos cambios dimensionales, actualmente se implementan técnicas de regeneración ósea guiada en el alveolo, con la finalidad de intentar reducir estos cambios. La técnica de regeneración ósea guiada consta de la utilización de tres herramientas básicas: células osteoprogenitoras, biomateriales osteoconductores y la presencia del factor de osteoinducción mediado por los factores de crecimiento (3–5).
Dentro de los biomateriales osteoconductores utilizados en la técnica de regeneración ósea guiada se encuentran las partículas óseas para relleno de cavidades óseas. En este sentido, las partículas óseas tienen diferente origen, y se clasifican en autólogas, alogénicas, xenogénicas y aloplásticas o sintéticas. Las partículas óseas autólogas, provienen del hueso obtenido del mismo paciente, y presenta como ventaja su carácter osteoinductivo y osteoconductor; mientras que su desventaja radica en que la técnica necesita un sitio dador que genera morbilidad postoperatoria y además existe una limitación en la cantidad de partículas de relleno que se obtiene. Para superar estas desventajas, hoy disponemos de partículas alogénicas, que son partículas óseas que provienen de la misma especie, pero de diferente individuo, o las xenogénicas que se obtienen de diferentes especies; ambas son sometidas a un procesado especial para eliminar la capacidad antigénica y poseen una gran capacidad osteoconductora. Por último, se encuentran las partículas aloplásticas o injertos sintéticos, las cuales se obtienen a partir de procesos de síntesis química y están constituidas a base de hidroxiapatita, fosfato tricálcico ó vidrio bioactivo; su función, al igual que las anteriores, es poseer una importante capacidad osteoconductora (6–10).
En odontología regenerativa, dos premisas fundamentales deben ser tenidas en cuenta, por un lado, la comprensión de la estructura histológica que se pretende regenerar, y por otro, el conocimiento en profundidad de los biomateriales utilizados en el proceso terapéutico (11). En este sentido, las partículas óseas de relleno deben tener como propiedades comunes el ser biocompatibles y biorreabsorbibles en el tiempo, para cumplir con su función de guiar o conducir y no alterar el normal funcionamiento del tejido óseo que se pretende regenerar. El carácter biorreabsorbible está muy vinculado al tamaño de partícula, por tal razón es fundamental conocer con precisión este aspecto de los biomateriales a utilizar. Por otro lado, las partículas alogénicas, xenogénicas y las aloplásticas son sometidas a distintos procesamientos durante su elaboración, lo que podría ocasionar modificaciones en su composición química. Si bien, se han realizado caracterizaciones químicas de distintas partículas óseas de relleno (12,13), no han sido valorados hasta el momento las mismas bajo la modalidad del microanálisis por energía dispersiva de rayos X (EPXMA). EPXMA constituye una técnica valiosa para estudiar la composición química de una muestra de manera cualitativa y cuantitativa, de forma simultánea a su observación microscópica. En este sentido dicha técnica sobre tejidos duros está ampliando el conocimiento de los diferentes grados de mineralización de una muestra (14–16).
El objetivo de este trabajo ha sido realizar un análisis morfométrico y de la composición química de distintas partículas óseas de rellenos utilizadas para tratamientos de regeneración ósea guiada en odontología.
MATERIALES Y MÉTODOS
Selección de muestras
Las muestras analizadas fueron partículas óseas de relleno del tipo alogénicas como MinerOss® (MO) (BioHorizons, Birmingham, AL, Estados Unidos) (Granulometría: 0,5 mm a 1 mm), Ostium® (OS) (Fundación Biotar, Santa Fé, Argentina) (Granulometría: 0,25 mm a 1,68 mm) y Matriz Ósea UNC® (UNC) (Laboratorio de Hemoderivados de la Universidad Nacional de Córdoba, Córdoba, Argentina) (Granulometría: 0,2 mm a 1mm). También se utilizaron xenogénicas como Bio-Oss® (BO) (Geistlichpharma AG, Wolhusen, Suiza)(Granulometría: 0,25 a 1 mm) y aloplásticas como GenPhos® (GP) (Genius, San Pablo, Brasil)(Granulometría: 0,5mm a 0,76mm). Como control se utilizó tejido óseo humano obtenido de cirugía de dientes retenidos intraóseos. Los fragmentos de tejido óseo control, una vez obtenidos fueron lavados con agua bidestilada y se incubó durante 1 hora a temperatura ambiente en placa de petri y se sometió al procesamiento para el microanálisis por energía dispersiva de rayos X que ha sido descrito más abajo.
Análisis morfométrico
El análisis morfométrico de cada una de las muestras se realizó mediante una lupa estereoscópica Olympus® (Tokio, Japón) para observar morfología superficial de las partículas de relleno. El estudio se realizó con un aumento de 50X. Posteriormente mediante el programa Image Pro® se obtuvo el diámetro de cada una de las partículas que integraban la muestra. Se analizaron 60 partículas por grupo experimental y se obtuvo una media con su desviación estándar, error típico, valores máximos y mínimos. Se aplicó el Test de Student para comparar medias y contrastar grupos de estudio en relación al diámetro equivalente de las partículas asumiendo como estadísticamente significativo un p< 0,05.
Microanálisis por energía dispersiva de rayos X (EPXMA)
Para el estudio microanalítico las muestras fueron criodesecadas en un aparato FreezedrierEmitech K 775 (Emitech, Watfor, UK) durante un total de 17 horas. Posteriormente, las muestras se montaron sobre un portamuestras de aluminio de 12 mm de diámetro, usando como adherente un doble adhesivo de carbón. Finalmente, las muestras fueron recubiertas con una capa de carbón mediante un evaporador (Emitech, Watford, UK) utilizando hilo de grafito.
El estudio microanalítico se llevó a cabo utilizando un Microscopio de Barrido Philips XL 30 (Philips Electronics NV, Einthoven, Netherlands) cuyas constantes fueron: voltaje= 15 kV, ángulo de superficie= 35º, spot size= 500 nm, ángulo de percepción= 61.34°. Para el análisis cuantitativo se utilizó un detector EDAX DX-4 (EDAX, Eindhoven, Holanda) cuyos parámetros analíticos fueron: aumento: 40000X, cuentas por segundo= 1200 y tiempo de acumulación de cuentas: 50 segundos. En el análisis se detectaron los elementos Ca y P y se determinó las cantidades en mmol/kg de esos elementos. Para este estudio se analizaron sales estándar de Ca y P y se utilizó la razón pico/fondo como método de cuantificación (14-16). Asimismo, se analizó la relación Ca/P de cada grupo experimental. Los resultados obtenidos en este estudio fueron representativos del análisis de 15 partículas óseas por grupo experimental. Para determinar distribución normal de datos de los diferentes grupos, se realizó la prueba no paramétrica de Kolmogorov-Smirnov. Luego se aplicó el Test de Student para comparar medias y contrastar grupos de estudio en relación a la cantidad de Ca y P.
RESULTADOS
Análisis morfométrico.
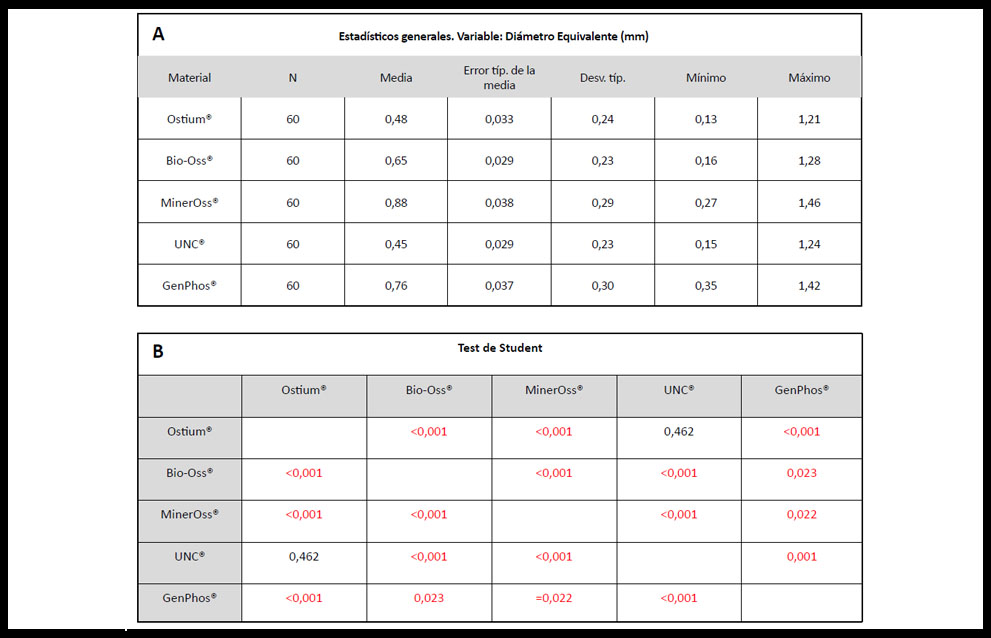
Los resultados obtenidos del análisis morfométrico para las distintas partículas óseas de relleno, muestran que las partículas de mayor tamaño en su valor medio fueron las de MO (0,88 mm), con una diferencia significativa sobre GP (0,76 mm) y esta a su vez sobre BO (0,65 mm). Las partículas más pequeñas en su valor medio fueron OS (0,48 mm) y UNC (0,45 mm) cuya diferencia entre ellas no fue significativa (Tabla 1 A y B).
Tabla 1. A) Tabla de estadísticos generales expresadas en mm para todas las partículas de relleno analizadas. B) Contrastes estadísticos entre distintos grupos experimentales a través del Test de Student. Los valores expuestos en rojo son los estadísticamente significativos (p<0,05).
Microanálisis por energía dispersiva de rayos X (EPXMA).
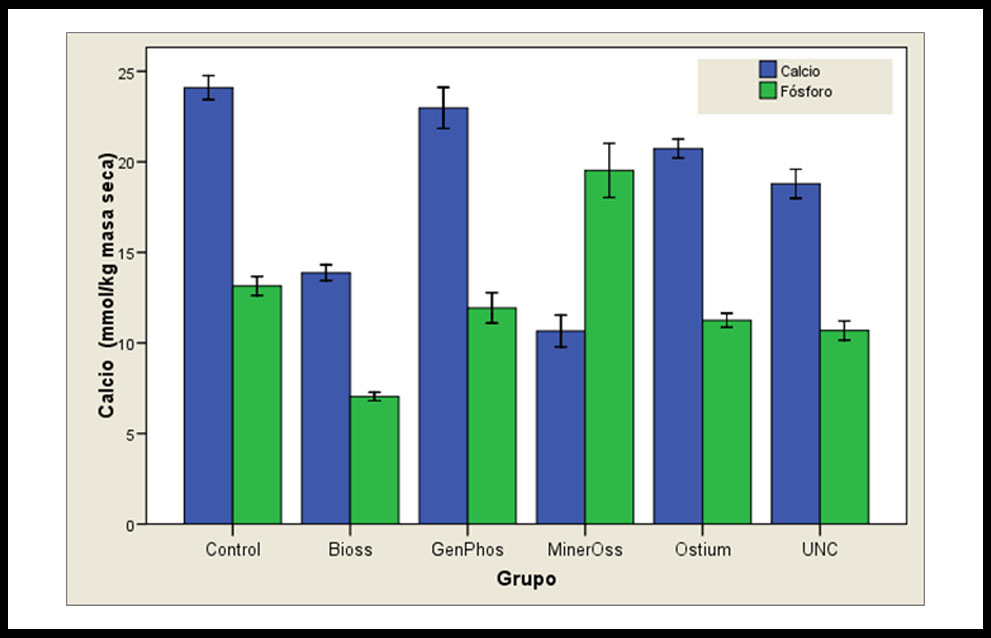
Los resultados microanalíticos cuantitativos procedentes de las partículas óseas de relleno y controles se expresan a continuación: los valores medios de Ca, en fracción de peso (mmol/kg) fueron para: Control= 24,09; BO= 13,87; GP= 22,97; MO=10,65; OS= 20,73; UNC= 18,79; (Figura 1). Por otra parte, los valores medios para P fueron: Control= 13,14; BO= 7,04; GP=11,93; MO= 19,52; OS= 11,25; UNC= 10,68 (Figura 1). Cuando se realizó el análisis estadístico del Ca, todas las partículas óseas menos GP poseen una concentración de Ca estadísticamente menor al control. Por otra parte, entre las partículas óseas de relleno no se encontró diferencias significativas entre GP y OS, y entre OS y UNC (Tabla 2). En relación al análisis estadístico del P, con respecto al control se observó que las únicas partículas con valores superiores y estadísticamente significativos fueron las de MO. Por el contrario, las demás mostraron valores inferiores al control, aunque GP fue el único que no mostró diferencia estadística. Al realizar el contraste estadístico de P en las distintas partículas óseas de los grupos experimentales se observó que entre GP y OS y entre OS y UNC no se observaron diferencias estadísticamente significativas (Tabla 2). Por otra parte, el análisis de la relación Ca/P evidenció un comportamiento similar en todos los grupos experimentales con respecto al control, a excepción de MO cuya relación Ca/P fue estadísticamente menor (Figura 2).
Figura 1. Resultados del estudio cuantitativo de Ca y P, expresados con los valores medios y su desviación estándar de 15 mediciones por grupo experimental.
Tabla 2. Contrastes estadísticos entre distintos grupos experimentales a través del Test de Student. Los valores expuestos en rojo son los estadísticamente significativos (p˂ 0,05).
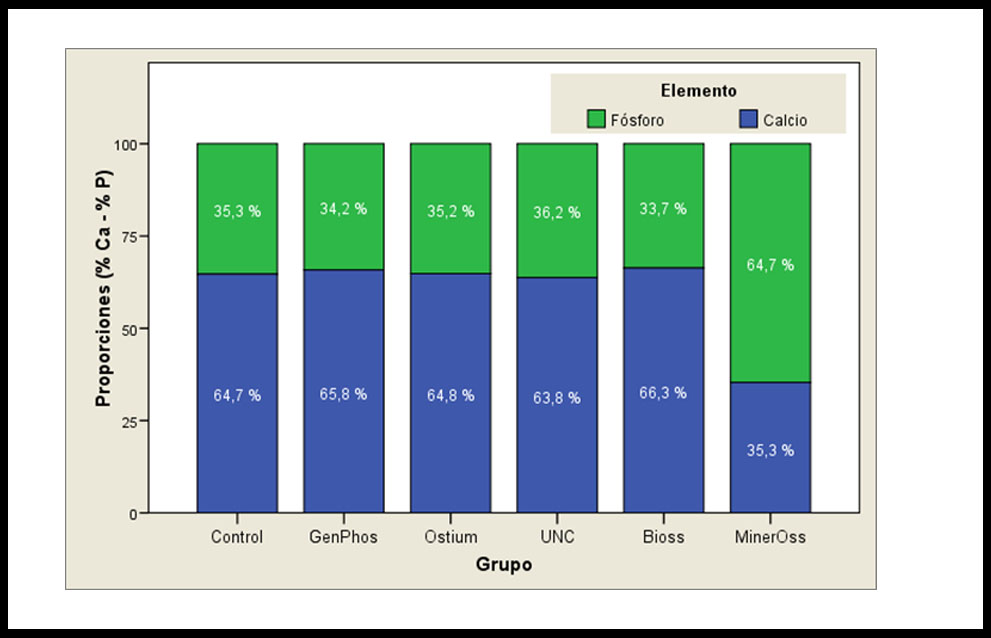
Figura 2. Resultados del estudio cuantitativo de la relación Ca/P expresada en porcentaje.
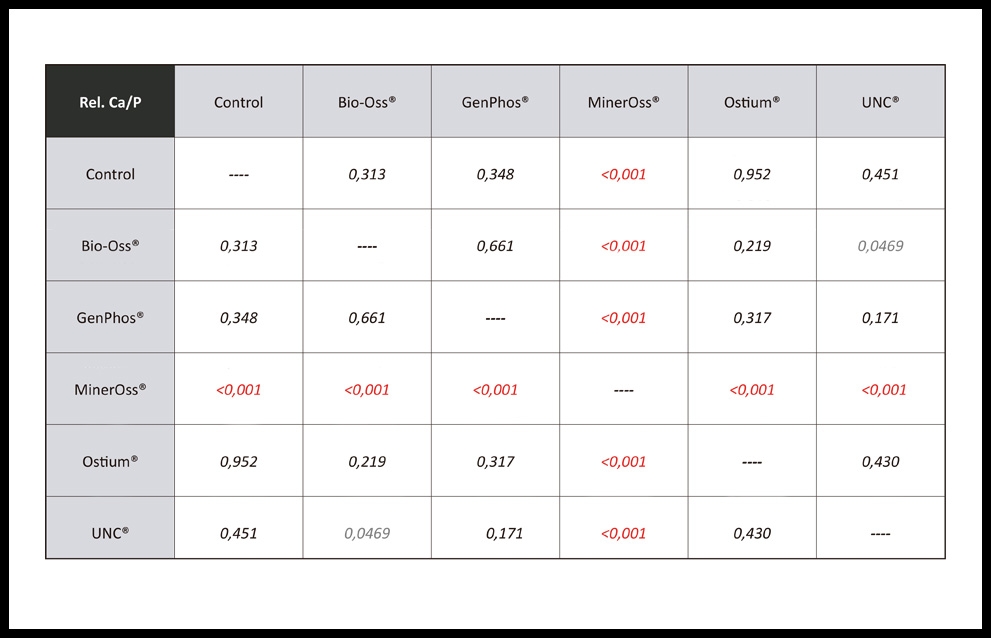
Los resultados de la relación Ca/P en los distintos grupos experimentales son para Control (1,83), GP (1,92), OS (1,84), UNC (1,81), BO (1,96), MO (0,54). Asimismo, se exponen los resultados en porcentajes en la figura 2. En la misma se observa que existe una mayor concentración de Ca en todos los grupos experimentales a excepción de MO que muestra una mayor concentración de P. Cuando se realiza el contraste estadístico entre los grupos experimentales, el único que evidencia una diferencia estadísticamente significativa es MO (Tabla 3)
Tabla 3. Contraste estadístico para la relación de Ca/P mediante Test de Student. Los valores expuestos en rojo son los estadísticamente significativos (p˂ 0,05).
DISCUSIÓN
En nuestro trabajo ha sido posible caracterizar la composición química de distintas partículas óseas de relleno utilizadas en tratamientos de regeneración ósea guiada en odontología, mediante la utilización de EPXMA. La técnica de EPXMA ha sido seleccionada en este trabajo ya que posibilita obtener mediciones precisas de elementos químicos involucrados en los procesos de mineralización de distintos tejidos duros (14–20), superando a los análisis cualitativos y semicuantitativos (12,13).
Cuando realizamos la caracterización química de las partículas de relleno con EPXMA, observamos que las mismas poseían Ca y P, aunque con algunas variaciones con respecto al control. Se conoce que estos dos elementos están vinculados a distintos procesos metabólicos del organismo, pero en especial al proceso de mineralización (21–23). El utilizar partículas óseas de relleno similares al tejido óseo en las técnicas de regeneración ósea guiada, permitiría incorporar dos elementos químicos sujeto de ser biodisponibles para el metabolismo de calcio-fósforo durante los procesos de regeneración ósea (24). Cuando realizamos el análisis cuantitativo con EXPMA, se observó que existían valores más bajos de Ca y P en las partículas óseas alogénicas y xenogénicas con respecto al control, mientras que las partículas óseas aloplásticas no evidenciaban diferencias significativas. Estos datos podrían estar relacionados con los tratamientos de elaboración, que en caso de las alogénicas y xenogénicas involucran la liofilización, desmineralización y desproteinización dependiendo el tipo de relleno que se trate (25–27). Cuando se analizó la relación Ca/P se observó que no existía diferencias significativas entre la mayoría de las partículas óseas con respecto al control, a excepción de MO que poseía una relación Ca/P significativamente menor. Conocer la relación Ca/P de las partículas óseas es trascendental en los procesos regenerativos, ya que relaciones óptimas permitirían una correcta adhesión de osteoblastos a las partículas (17,28,29). Se ha descrito que las partículas óseas xenogénicas injertadas en elevaciones de piso de seno maxilar poseen mayores concentraciones de Ca y una relación Ca/P mayor (1,9) que el tejido óseo regenerado alrededor de las partículas (1,4) (30). En el mismo sentido, estudios que han utilizado partículas de CaS para elevación de piso de seno, observaron mayores concentraciones de Ca y una relación Ca/P mayor (8,5) que la zona mineralizada que se produce alrededor de la partícula (1,63) (31). La diferencia en la concentración de Ca encontrado por los autores entre las partículas y el tejido circundante a las mismas difiere de nuestros resultados y pueden ser explicado por varias razones, por un lado, el modelo experimental usado fue in vivo, en segundo lugar, el método de medición fue la espectrometría por energía dispersiva de rayos X y por último el tejido con el que se comparan los resultados es un tejido óseo inmaduro o sea un tejido óseo regenerado reciente. Sin embargo, podría ayudar a explicar los bajos niveles de la relación Ca/P en MO, y poder especular que quizás estamos en presencia de partículas de relleno de tejido óseo inmaduro. Esta última explicación estaría respaldada por estudios realizados mediante EPXMA donde analizaron tejido óseo regenerado después de un tratamiento de regeneración tisular guiada de hueso alveolar mandibular en la zona anterior en un paciente joven. En el mismo, se observó que la relación Ca/P fue de 1,53, relación esta que está vinculada a la hidroxiapatita de un tejido óseo regenerado joven teniendo en cuenta que la relación Ca/P en esos huesos suele ser inferior a 1,67 (18). Por otra parte, aquellas partículas óseas de relleno que posean mayor concentración de Ca y P, serían las óptimas en los tratamientos de regeneración ósea, ya que como lo describen diversos estudios se sugiere que habría una gradual difusión de Ca y P desde el biomaterial injertado a la zona de nueva formación de tejido óseo (30,32). Sin embargo, la biodisponibilidad depende del proceso de biodegradación del material, y algunos autores han demostrado que las partículas óseas alogénicas, xenogénicas y aloplásticas presentan una lenta reabsorción al compararla con las partículas autólogas (33). En el caso de las partículas aloplásticas que contienen β-TCP, su proceso es más rápido (34).
Respecto al análisis morfométrico llevado a cabo en nuestro estudio, se observó que las partículas de relleno poseían tamaños medios entre 0,45 mm y 0,88 mm. Se ha demostrado que tamaños de partículas menores a 1 mm en rellenos autólogos y alogénicos permiten una buena actividad de células del tipo osteoclastos (35,36). Asimismo, cuando comparamos los valores medios del tamaño de partículas observamos que UNC y OS poseían el tamaño de partículas más pequeño que los demás grupos experimentales y esa diferencia fue estadísticamente significativa. Algunos autores han determinado que partículas de relleno alogénicas de un tamaño de 0,3 a 0,09 mm favorece la regeneración ósea al facilitar una rápida vascularización, mayor actividad osteoclástica/osteoblástica y formación de nuevo tejido óseo si se lo compara con partículas que llegan hasta 0,8 mm (37). En este sentido, si analizamos nuestros resultados desde la perspectiva de la biodegradación y biodisponibilidad de Ca y P, el menor tamaño de partícula permitiría una más rápida incorporación de Ca y P por parte de las células en los procesos regenerativos.
CONCLUSIÓN
La caracterización morfológica y química de las partículas óseas de relleno permitió conocer con mayor precisión el tamaño de las partículas óseas evaluadas, así como la concentración de Ca y P presente en las mismas. Las partículas de relleno que posean altas concentraciones de Ca y P y de tamaños más pequeños, permitirían una mayor biodisponibilidad de estos elementos en los procesos regenerativos óseos. Sin embargo, esos datos deben ser valorados junto a otros parámetros clínicos para obtener el tratamiento más apropiado en los procesos de regeneración ósea guiada en odontología.
Referencias bibliográficas
- Araújo MG, Silva CO, Misawa M, Sukekava F. Alveolar socket healing: what can we learn? Periodontol 2000. 2015;68(1):122-34.
- Araújo MG, Lindhe J. Dimensional ridge alterations following tooth extraction. An experimental study in the dog. J Clin Periodontol. 2005;32(2):212-8.
- Estrada C, Paz AC, López LE. Ingeniería de tejido óseo: consideraciones básicas. Rev EIA. 2006;(5):93-100.
- Ferraris MEG de, Muñoz AC. Histologa, embriologa e ingeniera tisular bucodental / Histology, embryology and oral tissue engineering. Ed. Médica Panamericana; 2009. 472 p.
- Vega DS. Principios básicos en Regeneración Ósea Guiada. Acta Bioclínica. 2012;2(3):94-121.
- Tortolini P, Rubio S. Diferentes alternativas de rellenos óseos. Av En Periodoncia E Implantol Oral. 2012;24(3):133-8.
- Naenni N, Bienz SP, Jung RE, Hämmerle CHF, Thoma DS. Histologic analyses of flapless ridge preservation in sockets with buccal dehiscence defects using two alloplastic bone graft substitutes. Clin Oral Investig. 2019;23(9):3589-99.
- Bronstein M, Nappe C, Villavicencio J, Toro H, Guiñez H. Preservación de alvéolos mediante fosfato tricálcico beta, con y sin membrana. Rev Clínica Periodoncia Implantol Rehabil Oral. 2016;9(2):168-74.
- Pereira RS, Menezes JD, Bonardi JP, Griza GL, Okamoto R, Hochuli-Vieira E. Comparative study of volumetric changes and trabecular microarchitecture in human maxillary sinus bone augmentation with bioactive glass and autogenous bone graft: a prospective and randomized assessment. Int J Oral Maxillofac Surg. 2018;47(5):665-71.
- Martín-Piedra A, Martin-Piedra L. Matrices para Ingeniería del tejido óseo. Actual Médica. 2019;104(806):36-45.
- Rodriguez IA, Rodriguez MA, Uribe Echevarria J. La biocompatibilidad en odontología regenerativa. Dental Tribune. 2019.
- Figueiredo M, Henriques J, Martins G, Guerra F, Judas F, Figueiredo H. Physicochemical characterization of biomaterials commonly used in dentistry as bone substitutes—Comparison with human bone. J Biomed Mater Res B Appl Biomater. 2010;92(2):409-19.
- Accorsi-Mendonça T, Conz MB, Barros TC, de Sena LA, Soares G de A, Granjeiro JM. Physicochemical characterization of two deproteinized bovine xenografts. Braz Oral Res. 2008;22(1):5-10.
- Sánchez-Quevedo MC, Ceballos G, García JM, Rodríguez IA, Gómez de Ferraris ME, Campos A. Scanning electron microscopy and calcification in amelogenesis imperfecta in anterior and posterior human teeth. Histol Histopathol. 2001;16(3):827-32.
- Sánchez-Quevedo MC, Ceballos G, García JM, Luna JD, Rodríguez IA, Campos A. Dentine structure and mineralization in hypocalcified amelogenesis imperfecta: a quantitative X-ray histochemical study. Oral Dis. 2004;10(2):94-8.
- Sánchez-Quevedo C, Ceballos G, Rodríguez IA, García JM, Alaminos M. Acid-etching effects in hypomineralized amelogenesis imperfecta. A microscopic and microanalytical study. Med Oral Patol Oral Cirugia Bucal. 2006;11(1):E40-43.
- Kalia P, Vizcay-Barrena G, Fan JP, Warley A, Di Silvio L, Huang J. Nanohydroxyapatite shape and its potential role in bone formation: an analytical study. J R Soc Interface. 2014;11(93):20140004.
- González-Jaranay M, del Carmen Sánchez-Quevedo M, Moreu G, García JM, Campos A. Electron Microprobe Analysis in Guided Tissue Regeneration: A Case Report. Eur J Dent. enero de 2007;1(1):40-4.
- Sigee DC, Morgan J, Sumner AT, Warley A. X-ray Microanalysis in Biology: Experimental Techniques and Applications. Cambridge University Press; 1993. 356 p.
- Wright JT, Robinson C, Shore R. Characterization of the enamel ultrastructure and mineral content in hypoplastic amelogenesis imperfecta. Oral Surg Oral Med Oral Pathol. 1991;72(5):594-601.
- Dominguez Lopez M, Martinez Almazaan E, Muñoz Romero C, Álvarez Martin A, Garcia Navarro JA. Interpretación de las pruebas de metabolismo calcio-fósforo. En: Tratado de geriatría para residentes. Sociedad Española de Geriatría y Gerontología; 2006. 816 p.
- Yuan H, de Groot K. Calcium Phosphate Biomaterials: An Overview. En: Reis RL, Weiner S, editores. Learning from Nature How to Design New Implantable Biomaterialsis: From Biomineralization Fundamentals to Biomimetic Materials and Processing Routes. Springer Netherlands; 2005. p. 37-57.
- Sapir-Koren R, Livshits G. Bone mineralization and regulation of phosphate homeostasis. IBMS BoneKEy. 2011;8(6):286-300.
- Lazáry A, Balla B, Kósa J, Bácsi K, Nagy Z, Takács I, et al. [Review of the application of synthetic bone grafts. The role of the gypsum in bone substitution: molecular biological approach, based on own research results]. Orv Hetil. 2007;148(51):2427-33.
- Varanasi VG, Velten MF, Odatsu T, Ilyas A, Iqbal SM, Aswath PB. Chapter 9 – Surface Modifications and Surface Characterization of Biomaterials Used in Bone Healing. En: Bose S, Bandyopadhyay A, editores. Materials for Bone Disorders. Academic Press; 2017. p. 405-52.
- Zoricic S, Bobinac D, Lah B, Maric I, Cvijanovic O, Bajek S, et al. Study of the healing process after transplantation of pasteurized bone grafts in rabbits. Acta Med Okayama. 2002;56(3):121-8.
- Sbordone C, Toti P, Guidetti F, Califano L, Pannone G, Sbordone L. Volumetric changes after sinus augmentation using blocks of autogenous iliac bone or freeze-dried allogeneic bone. A non-randomized study. J Cranio-Maxillo-fac Surg Off Publ Eur Assoc Cranio-Maxillo-fac Surg. 2014;42(2):113-8.
- Wang C, Duan Y, Markovic B, Barbara J, Howlett CR, Zhang X, et al. Phenotypic expression of bone-related genes in osteoblasts grown on calcium phosphate ceramics with different phase compositions. Biomaterials. 2004;25(13):2507-14.
- Fan Y-P, Lu J-F, Xu A-T, He F-M. Physiochemical characterization and biological effect of anorganic bovine bone matrix and organic-containing bovine bone matrix in comparison with Bio-Oss in rabbits. J Biomater Appl. 2018;33(4):566-75.
- Traini T, Degidi M, Sammons R, Stanley P, Piattelli A. Histologic and elemental microanalytical study of anorganic bovine bone substitution following sinus floor augmentation in humans. J Periodontol. 2008;79(7):1232-40.
- Slater N, Dasmah A, Sennerby L, Hallman M, Piattelli A, Sammons R. Back-scattered electron imaging and elemental microanalysis of retrieved bone tissue following maxillary sinus floor augmentation with calcium sulphate. Clin Oral Implants Res. 2008;19(8):814-22.
- Ramírez-Fernández MP, Calvo-Guirado JL, Maté-Sánchez Del Val JE, Delgado-Ruiz RA, Negri B, Barona-Dorado C. Ultrastructural study by backscattered electron imaging and elemental microanalysis of bone-to-biomaterial interface and mineral degradation of porcine xenografts used in maxillary sinus floor elevation. Clin Oral Implants Res. 2013;24(5):523-30.
- Martínez Álvarez O, Barone A, Covani U, Fernández Ruíz A, Jiménez Guerra A, Monsalve Guil L, et al. Injertos óseos y biomateriales en implantología oral. Av En Odontoestomatol. 2018;34(3):111-9.
- Artzi Z, Weinreb M, Givol N, Rohrer MD, Nemcovsky CE, Prasad HS, et al. Biomaterial resorption rate and healing site morphology of inorganic bovine bone and beta-tricalcium phosphate in the canine: a 24-month longitudinal histologic study and morphometric analysis. Int J Oral Maxillofac Implants. 2004;19(3):357-68.
- Kon K, Shiota M, Ozeki M, Yamashita Y, Kasugai S. Bone augmentation ability of autogenous bone graft particles with different sizes: a histological and micro-computed tomography study. Clin Oral Implants Res. 2009;20(11):1240-6.
- Chackartchi T, Iezzi G, Goldstein M, Klinger A, Soskolne A, Piattelli A, et al. Sinus floor augmentation using large (1-2 mm) or small (0.25-1 mm) bovine bone mineral particles: a prospective, intra-individual controlled clinical, micro-computerized tomography and histomorphometric study. Clin Oral Implants Res. 2011;22(5):473-80.
- Malinin TI, Carpenter EM, Temple HT. Particulate bone allograft incorporation in regeneration of osseous defects; importance of particle sizes. Open Orthop J. 2007;1:19-24.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: María Belén Ferrer. Facultad de Odontología, Universidad Nacional de Córdoba. Luis de la Cruz 296 · Córdoba, Argentina. E-mail: mariabelenferrer@unc.edu.ar