Original
Terapia sustitutiva en la túnica esclerótica. Identificación de patologías y metodologías utilizadas en el Complejo Hospitalario de la Universidad de Granada (2014-2019)
Substitute therapy of the sclera. Identification of the patologies and methodologies in the University Hospital of Granada (2014-2019)
Actual. Med. 2019; 104: (808): 159-163 DOI: 10.15568/am.2019.808.or02
Enviado: 02-08-2019
Revisado: 16-09-2019
Aceptado: 03-12-2019
RESUMEN
Introducción: La esclera es un tejido avascular compuesto por tejido conectivo denso cuya función principal es proteger las estructuras intraoculares. Existen diversas patologías que ponen en riesgo la integridad de dicho tejido y, en consecuencia, pueden provocar terribles secuelas con un pronóstico nefasto. El tratamiento sustitutivo forma parte de la terapia de dicha patología, siendo el injerto de esclerótica cadáver una opción biocompatible y biomimética a valorar. El injerto de esclerótica de cadáver es un tejido de fácil acceso y con buenos resultados post-quirúrgicos por lo que no solo es usado en el ámbito de la patología escleral, sino que también es utilizado para cirugía de oculoplástica, glaucoma o de retina. No obstante, el peligro de transmisión de priones o el déficit de suministro en algunos países hacen que este tejido sea suplantado por otros tejidos o técnicas quirúrgicas.
Métodos: Los objetivos de este estudio son identificar la patología esclerótica susceptible de terapia sustitutiva en los últimos 5 años en el complejo hospitalario universitario de Granada, identificar los métodos empleados como terapéutica sustitutiva en dicha patología y evaluar la práctica de dicha terapia en el contexto de la bibliografía existente al respecto. Para ello, se aplicó un diseño retrospectivo en el que se realizó una búsqueda en los archivos de la unidad de documentación clínica del Hospital Clínico San Cecilio y Hospital Virgen de las Nieves, de los cuales se obtuvieron 9 casos clínicos.
Resultados: Entre los 9 casos clínicos, solo 4 fueron sometidos a tratamiento quirúrgico, y de estos, 3 de ellos a terapia sustitutiva por membrana amniótica o injerto escleral. En los 5 casos restantes no se llevó a cabo ninguna técnica quirúrgica, no obstante, podría ser de gran valor el uso del refuerzo con injerto de esclerótica en los casos con escleromalacia para evitar complicaciones futuras. La esclerótica procedente de cadáver se postula como una opción con unos resultados prometedores; sin embargo, las líneas de investigación actuales apuestan por el desarrollo de un sustituto basado en las ventajas de la fibrina agarosa que supla los puntos negativos del tejido donante.
Palabras clave: Terapia sustitutiva; Injerto de esclerótica; Membrana amniótica; Patología de la esclerótica.
ABSTRACT
Introduction: The sclera is an avascular tissue composed of dense connective tissue whose main function is to protect intraocular structures. There are several pathologies that jeopardize the integrity of this tissue and, consequently, can cause terrible consequences with a dire prognosis. Substitute treatment is part of the therapy of this pathology, with the donor sclera graft being a biocompatible and biomimetic option to be evaluated. The donor sclera graft is an easily accessible tissue with good post-surgical results, so it is not only used in the field of scleral pathology, but also used for oculoplastic, glaucoma or retinal surgery. However, the danger of prion transmission or the supply deficit in some countries causes that, other tissues or surgical techniques supplant this tissue.
Methods: The objectives of this study are to identify the sclerotic pathology susceptible of replacement therapy in the last 5 years in the university hospital of Granada, identify the methods used as a replacement therapy in this pathology and evaluate the practice of such therapy. A retrospective design was applied and a search was made in the archives of the clinical documentation unit of the an Cecilio Clinical Hospital and Virgen de las Nieves Hospital. There were 9 clinical cases found.
Results: Among the nine clinical cases, only 4 were subjected to surgical treatment, and of these, three of them for replacement therapy of donor sclera or amniotic membrane. In the remaining 5 cases did not carry out any surgical technique, however, it could be of great value using reinforcement sclera graft in cases with scleromalacia to avoid further complications. Sclera from cadaver is postulated as an option with promising results; however, current research committed to the development of a substitute based on the advantages of fibrin agarose that mitigates the negative points of the donor tissue.
Keywords: Substitute therapy; Scleral graft; Amniotic membrane; Scleral pathology.
Leer Artículo Completo
INTRODUCCIÓN
Esclera es una palabra que deriva del griego “σκληρός” o “eskleros” que a su vez significa “duro˝ y constituye un tejido prácticamente avascular, rígido y compuesto por tejido conectivo denso. Su función principal no es otra que proteger las estructuras intraoculares. Es resistente a las fluctuaciones de la presión intraocular facilitando el drenaje acuoso y a su vez, también sirve de anclaje a los músculos extraoculares y el cuerpo ciliar (1, 2).
Histológicamente, la esclera es una capa compuesta principalmente por un tejido conectivo denso que contiene fibroblastos dispersos inmersos en una matriz extracelular rica en colágeno altamente densa(3). Su debilitamiento y adelgazamiento no es una complicación rara y resulta incluso frecuente tras procedimientos tales como la escisión de pterigium, cirugía de desprendimiento de retina, vasculitis sistémicas, miopía magna o traumatismos (4-9).
El refuerzo de la esclera debilitada o perforada es necesario sobretodo cuando se expone la coroides, para evitar el prolapso del contenido ocular, o de infecciones secundarias comprometiendo la visión y la calidad de vida de muchos pacientes (10, 11). Una gran parte de las escleropatías están asociadas a colagenopatías vasculares sistémicas como la artritis reumatoide, y además muchas se acaban perforando como ocurre a veces en la osteogénesis imperfecta, lo que acaba en una gran mayoría de casos en la ceguera del paciente (12, 13).
La esclera esta compuesta por tres capas: epiesclera, estroma y lamina fusca. La epiesclera es un tejido muy fino y muy vascularizado formado por tejido conectivo. A su vez encontramos el plexo epiescleral. En el mismo los vasos son rectos y de configuración radial. La epiescleritis se produce a nivel de esta capa y a nivel de la conjuntiva. El estroma es la capa de más espesor constituyendo el 95% del grosor de la esclera. Es un tejido avascular que recuerda al estroma de la córnea. La esclera también está constituida por la lamina fusca que a su vez da forma a la superficie interna de la esclera, es avascular y tiene aproximadamente 5 micras de grosor.
El grosor de la esclera varía despendiendo de la zona, siendo en la parte posterior del globo ocular donde es más gruesa (1.0 – 1,35mm). La zona donde se encuentra más adelgazada es donde se insertan los músculos rectos (0.3mm de grosor aproximado)(1).
Para el tratamiento de la patología arriba indicada que genera debilitamiento en la esclerótica, uno de los recursos terapéuticos de elección es la sustitución de la esclerótica alterada. Para realizar una adecuada terapia de sustitución es necesario utilizar elementos que sean lo más biocompatibles y biomiméticos posibles en relación con la estructura histológica de la esclerótica previamente descrita.
En este sentido la utilización de esclerótica de cadáver ha sido utilizada como terapia sustitutiva en algunas de las patologías relacionadas de la esclerótica indicadas con anterioridad. La esclerótica es un tejido de fácil acceso y manipulable, y ha demostrado dar buenos resultados postquirúrgicos. Es de muy fácil extracción en donante y puede ser bien conservado durante meses(14) y al tratarse de un tejido avascular es bien tolerado por el receptor, provocando muy poca inflamación(10, 15). Es por ello por lo que tiene muchísimas indicaciones quirúrgicas en el ámbito de la terapia sustitutiva en oftalmología, como ocurre en la cirugía del glaucoma, oculoplástica, desprendimiento de retina, escleromalacia, melanoma, miopía magna, etc. (4-9). Pero es en los casos de escleritis perforantes graves donde con más frecuencia es necesaria la reparación quirúrgica con injertos (16). Es en este contexto en el que se usa ampliamente el implante del injerto escleral alogénico de cadáver (17). Aunque recientemente se han utilizado otros elementos sustitutivos para la esclerótica (ej. membrana amniótica, implante de tenon o implantes dermatológicos) los resultados obtenidos no son del todo concluyentes (16, 18).
El presente trabajo tiene por objeto analizar la patología de la túnica esclerótica susceptible de posible terapia sustitutiva en el complejo hospitalario universitario de Granada durante los últimos 5 años con la finalidad de examinar las distintas soluciones terapéuticas aplicadas, considerar la evolución clínica derivada de la aplicación de dichas terapias y evaluar dichos resultados en el contexto de la bibliografía existente al respecto en relación con las nuevas modalidades de sustitutos propuestos.
MATERIAL Y MÉTODOS
Para llevar a cabo este estudio se realizó una investigación retrospectiva en el servicio de documentación clínica del hospital universitario clínico San Cecilio de Granada y del Hospital Virgen de las Nieves de Granada. Para ello se realizó una búsqueda con la codificación de “escleritis”, “escleromalacia” y “perforación escleral”. También se realizó una búsqueda por “procedimiento terapéutico escleral”, codificando en este caso cualquier tratamiento en que se implique la cirugía de la esclera.
Se consideraron variables como edad, sexo del paciente, diagnóstico principal y procedimiento terapéutico, además de si fue necesaria la intervención quirúrgica. Se consideró igualmente el periodo de recuperación que se estableció en días, cicatrización, buen control, alta del paciente o revisión en un mes. Con respecto al seguimiento y post-tratamiento, se consideró la existencia de recidiva y si hubo re-intervención y de que tipo. Por ultimo se consideró el parámetro de infección post-quirúrgica en pacientes operados.
RESULTADOS
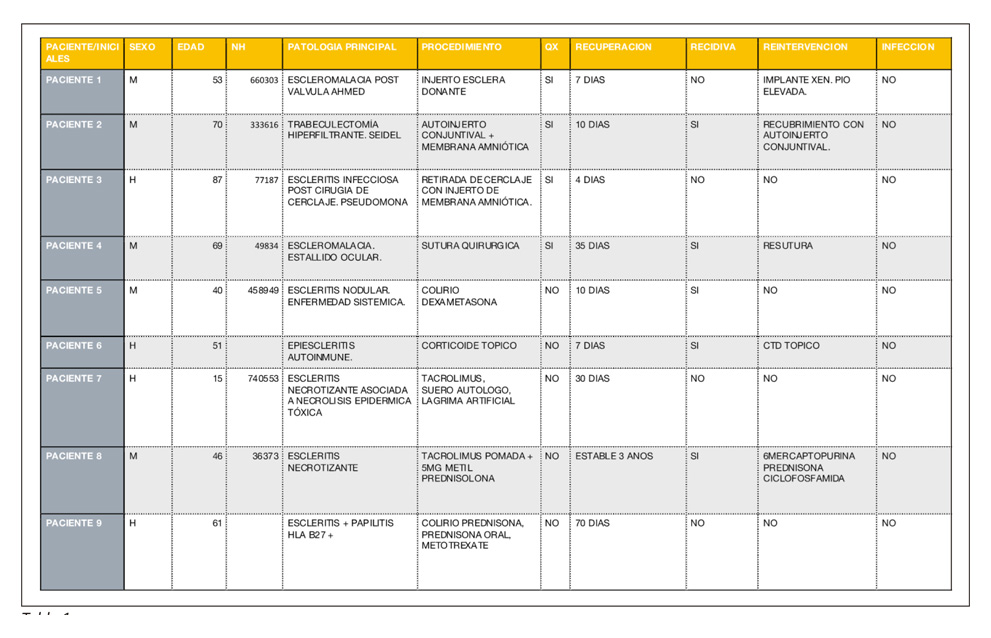
El estudio retrospectivo que se realizó en el servicio de documentación clínica del complejo hospitalario universitario de Granada puso en relieve los resultados expuestos en la Tabla1.
Tabla 1.
Del total de búsquedas realizadas con los indicadores señalados en material y métodos fueron seleccionados 9 pacientes que cumplían los requisitos de portar una patología escleral susceptible de tratamiento quirúrgico sustitutivo. De los 9 pacientes 4 eran varones y 5 mujeres. 6 pacientes de ellos superaban los 50 años. De los 9 pacientes solo 4 fueron tratados quirúrgicamente y, a su vez, de estos 4 solo en 3 de ellos se optó por tratamiento sustitutivo (en dos casos el uso de membrana amniótica y en uno de ellos el uso de esclera donante). El tratamiento sustitutivo obtuvo recuperaciones relativamente cortas, de entre 4 y 10días. El tratamiento sustitutivo empleó varios meses de seguimiento hasta recuperación. En los 5 casos restantes no se ha empleado ninguna técnica quirúrgica. Las características de cada uno de los pacientes se describe a continuación.
El caso numero 1 fue un paciente que desarrolló una escleromalacia postiquirúrgica a raíz del implante una válvula de Ahmed. En este caso se optó por un refuerzo de esclera donante tras lo cual la recuperación fue rápida y solo tuvo que re-intervenirse por obstrucción de la válvula. En el caso numero 2 se trata de una paciente operada de trabeculectomía que hiperfiltraba y se optó por el uso de conjuntiva y membrana amniótica. La paciente mejoró a los 10 dias con buena recuperación aunque tuvo que ser re-intervenida con auto-injerto de conjuntiva. El caso numero 3 fue un paciente operado de desprendimiento de retina con un cerclaje que comenzó con escleritis infecciosa positiva para pseudomona aeuriginosa cuya intervención hubo que desbridar y se optó por membrana amniótica para refuerzo del tejido. El paciente tuvo una recuperación prematura a los cuatro días, aunque continúo con seguimiento estrecho por parte del servicio de oftalmología. No hubo recidivas ni infección post-quirúrgica. La paciente numero 4 padecía de una escleromalacia de larga evolución que tras un traumatismo produjo el estallido ocular. En este caso no fue necesario el uso de tejidos de sustitución y se empleó la sutura. La recuperación fue tórpida y muy lenta con escasos resultados post quirúrgicos y mal pronostico. El caso de la paciente numero 5 se trata de una escleritis nodular que no ha recidivado hasta el momento y el tratamiento detuvo el proceso a partir de los 10 días. El paciente numero 6 presentaba una epiescleritis que se trató con corticoides tópicos y recidivó, tras lo cual fue con el mismo tratamiento. El paciente numero 7 presentó una escleritis necrotizante asociada a necrolísis epidérmica tóxica. El paciente recibió un tratamiento inmunosupresor tras lo cual no hubo recidivas esclerales por lo que no se llegó a necesitar intervención quirúrgica por este motivo. El paciente numero 8 diagnosticado de esclertitis necrotizante que se controló con tratamiento inmunosupresor tuvo una recidiva a los 3 años, tras lo que se optó por el mismo tratamiento para detener el proceso. La paciente numero 9 diagnosticada de escleritis posterior con pérdida de visión que obtuvo tratamiento supresor y una recuperación lenta, no ha vuelto a tener recidivas aunque sigue estrecho control por secuelas.
DISCUSIÓN
En este estudio realizamos una evaluación de la patología de la esclerótica susceptible de tratamiento por reconstrucción quirúrgica mediante el uso de sustitutos alternativos tales como el tejido escleral donante, la membrana amniótica, injerto conjuntival o de Tenon. El estudio pone en relieve que la patología escleral susceptible de terapia sustitutiva en el complejo hospitalario universitario de Granada es escasa en relación con el numero de pacientes que acuden en la actualidad al servicio de oftalmología por cualquier otra causa. Es posible que el sistema de codificación utilizado en distintos momentos por los hospitales de la región pueda haber actuado como una limitación en la recopilación de datos de la investigación.
La patología más prevalente en nuestra base de datos fue la escleritis, constituyendo dicha patología un posible factor predisponente de la escleromalacia que a su vez aumenta drásticamente el riesgo de perforación y, por tanto, las posibilidades de necesitar tratamiento quirúrgico sustitutivo. Puede ser un posible tratamiento preventivo en estos casos la terapia sustitutiva con parche escleral junto con membrana amniótica, evitando así la sintomatología y el riesgo de perforación inminente en estos pacientes (19), también la duramadre como injerto ha sido propuesta con resultados favorables en algunos casos de escleromalacia (20). De la base de datos adquirida en este estudio, 7 de 9 pacientes empezaron como escleritis, de entre ellos, 6 fueron de causa inmune, mientras que la escleritis restante (el paciente 3) fue de causa infecciosa tras una intervención quirúrgica con cerclaje (constituyendo esta causa un 1.6% de los casos de uso de parche de esclerótica (17). Este ultimo caso fue intervenido con membrana amniótica y antibióticos con la finalidad de evitar la perforación ocular. En los casos de escleritis necrotizante de tipo infecciosa la membrana amniótica ha demostrado mejores resultados que la esclera, ya que disminuye la inflamación y a su vez no tiene tan altos niveles de fibrina que favorecen en algunos casos la progresión de la infección (21). De entre los 6 casos de escleritis inmune, el paciente 4 que estaba diagnosticado de escleromalacia crónica sufrió una perforación por un traumatismo, la cual en base al pronóstico de la paciente se decidió no usar ningún biomaterial sustitutivo. Los 5 pacientes restantes son susceptibles de recidiva, desarrollar escleromalacia o escleritis necrotizante y por tanto del uso de terapia sustitutiva para tratamiento o prevención de la rotura ocular (19)
Por otro lado, el implante de esclerótica es un recurso muy frecuentemente utilizado en la cirugía de glaucoma, siendo hasta un 80,9% de las escleras donantes usadas por este tipo de cirugías (17). Entre sus usos esta la adaptación en las válvulas de Ahmed (8) o en trabeculectomías con hiperfiltración (9). Es el caso del paciente numero 2, que se sometió a intervención quirúrgica con membrana amniótica y autoinjerto conjuntival por hiperfiltración post-trabeculectomía, tras lo que se obtuvo una recuperación temprana en aproximadamente 10 días, aunque no obstante tuvo que ser re-intervenido por el mismo motivo. En este tipo casos el uso de parche de esclerótica ha demostrado mejores resultados que la membrana amniótica y el injerto conjuntival (9). El caso numero 1 es un paciente con escleromalacia causada por la inserción de una válvula de Ahmed. Se intervino mediante un injerto de esclera donante, que no tuvo complicaciones post-quirúrgicas y obtuvo una recuperación temprana (7 días). En este ultimo caso la finalidad de la intervención quirúrgica fue evitar la extrusión de la válvula, no obstante como ya hemos descrito previamente también se disminuye el riesgo de perforación.
Por tanto, la esclerótica, como dijimos con anterioridad, se trata de un tejido muy manipulable, con muchas indicaciones y buenos resultados postquirúrgicos, además de bien tolerado por el receptor (10, 15). No obstante el trasplante alogénico de esclera también conlleva algunos riesgos, como el contagio de enfermedades. La Therapeutic Goods Asministration (TGA) impuso el requerimiento de realizar un test de ácidos nucleicos en la esclera para controlar enfermedades como HBV, HVC o HIV para evitar el riesgo de contagio. Es imprescindible la serología de estos mismos virus, junto con HTLV y sífilis(17, 22, 23). Es sin embargo la transmisión de priones o proteínas priónicas uno de los riesgos más transcendentales de este procedimiento, como en el caso de la enfermedad de Creutzfeld-Jacob, que aunque ocurre en no muy numerosos casos (1 de cada millón de habitantes al año), ha de advertirse siempre previamente al paciente (24). En la mayoría de las ocasiones es prácticamente imposible detectar mediante Western blot o técnicas de inmunohistoquímica esta proteína en la cornea o en esclera, debido a los ínfimos niveles de ésta. No obstante hemos de considerar siempre el riesgo debido a la proximidad de este tejido al tejido neuronal. Es por tanto, que hayan de tomarse tantas de medidas preventivas en la exclusión de donantes, materias desechable en la extracción y protocolos de manipulación y almacenamiento en los bancos de tejidos(25).
Estos controles retrasan el almacenamiento, lo cual, acompañado con el incremento de demanda de tejido en los últimos años en Europa y las complicaciones que suponen algunos métodos de almacenamiento, desencadenan en que el uso de otras alternativas biogénicas al tejido de esclerótica sean cada vez opciones más a desarrollar (17, 24). Por estas razones, se evaluaron diferentes injertos y biomateriales (por ejemplo, membrana amniótica, injertos de tenón o los injertos dérmicos), pero los estudios experimentales y clínicos demostraron un éxito variable(16, 18, 26). Por eso hoy en día aun son necesarios nuevos sustitutos posibles. En los últimos años, el hidrogel de fibrina-agarosa se ha utilizado con éxito para generar modelos similares a tejidos con bioingeniería para aplicaciones clínicas (27-29). Después de estudios ex vivo y en estudios vivo-preclínicos, los modelos basados en fibrina agarosa de córnea y piel se elaboraron como productos médicos avanzados en condiciones GMP(Good manufacturing practices) para uso clínico (30). Estudios recientes demostraron la posibilidad de mejorar las propiedades estructurales, biomecánicas y biológicas de la fibrina agarosa mediante el uso de la técnica de nano-estructuración, el uso de agentes reticulantes químicos o la combinación de ambos (31, 32). Basándose en las ventajas que ofrece la fibrina agarosa sobre el desarrollo de la cornea, se esta hoy en día desarrollando un posible biomaterial como sustituto de esclerótica para toda la patología susceptible de trasplante(33).
CONCLUSIÓN
La patología de la esclerótica no es excesivamente prevalente en el medio, no obstante, de no llevar a cabo un control exhaustivo, su evolución puede tener un pronóstico nefasto. Es por ello, que se considera la terapia sustitutiva una solución cada vez más a tener en cuenta en las complicaciones graves y prevención de dichas enfermedades. La esclerótica donante de cadáver es una opción con buenos resultados, aunque la dificultad de obtención en algunos casos y las complicaciones infecciosas impulsan el desarrollo de biomateriales que puedan suplantar dicho tejido evitando problemas de suministro y los posibles efectos secundarios.
REFERENCIAS BIBLIOGRÁFICAS
- Kanski, Jack J., Brad Bowling, Ken K Nischal, and Andrew Pearson. Clinical Ophthalmology: A Systematic Approach. 7th ed. Edinburgh ; New York: Elsevier/Saunders, 2011.
- Sternberg SS, Sternberg, Stemberg, Stenberg. Histology for pathologists: Lippincott-Raven Philadelphia; 1997.
- Harper AR, Summers JA. The dynamic sclera: extracellular matrix remodeling in normal ocular growth and myopia development. Exp Eye Res. 2015;133: 100-111.
- Siatiri H, Mirzaee-Rad N, Aggarwal S, Kheirkhah A. Combined tenonplasty and scleral graft for refractory Pseudomonas scleritis following pterygium removal with mitomycin C application. J Ophthalmic Vis Res. 2018;13(2): 200-202.
- Delgado M, Ayala E, Montesinos B, Gutiérrez R, Pérez J, Martínez-Barona F. Injerto de esclera: nuestra experiencia. Arch Soc Canar Oftal. 2000; 11: 19-22.
- Stunf S, Lumi X, Drnovšek-Olup B. Preserved scleral patch graft for unexpected extreme scleral thinning found at the scleral buckling procedure: A case report. Indian J Ophthalmol. 2011;59(3): 235-8.
- Barman M, Finger PT, Milman T. Scleral patch grafts in the management of uveal and ocular surface tumors. Ophthalmol. 2012;119(12): 2631-2636.
- Brandt JD. Patch grafts of dehydrated cadaveric dura mater for tube-shunt glaucoma surgery. Arch Ophthalmol. 1993;111(10):1436-1439.
- Mardelli PG, Mardelli ME, Bakkour Z. A Novel Hinged Scleral Patch Graft for the Repair of Overfiltration and Bleb Leaks. J Glaucoma. 2018;27(4): 377-381.
- Sangwan V, Jain V, Gupta P. Structural and functional outcome of scleral patch graft. Eye (Lond). 2007;21(7): 930-5.
- Ferretti M, Marra KG, Kobayashi K, Defail AJ, Chu CR. Controlled “in vivo” degradation of genipin crosslinked polyethylene glycol hydrogels within osteochondral defects. Tissue Eng. 2006;12(9): 2657-2663.
- Salcone EM, Hamdy S, Melki S, Hunter DG. Scleral perforations during routine traction test in a patient with osteogenesis imperfecta. J AAPOS. 2014; 18(6): 610-2.
- Tsai C-L, Wu P-C, Fini ME, Shi S. Identification of multipotent stem/progenitor cells in murine sclera. Invest Ophthalmology Vis Sci. 2011;52(8): 5481-5487.
- Töteberg-Harms M, Bredehorn-Mayr T. Preparation and use of human sclera grafts in ophthalmic surgery. Dev Ophthalmol. 2009; 43:105-108..
- González del Valle F, Álvarez Portela M, Lara Medina J, Celis Sánchez J, Barrajón Rodríguez A. Técnica de extracción de esclera donante mediante extrusión del globo ocular. Arch Soc Esp Oftalmol. 2012;87(9): 294-296.
- Hanada K, Shimazaki J, Shimmura S, Tsubota K. Multilayered amniotic membrane transplantation for severe ulceration of the cornea and sclera. Am J Ophthalmology. 2001;131(3): 324-331.
- Hodge C, Sutton G, Devasahayam R, Georges P, Treloggen J, Cooper S, et al. The use of donor scleral patch in ophthalmic surgery. Cell Tissue Bank. 2017;18(1):119-128.
- Mauriello J, Pokorny K. Use of split-thickness dermal grafts to repair corneal and scleral defects–a study of 10 patients. Br J Ophthalmol. 1993;77(6): 327-331.
- Oh JH, Kim JC. Repair of scleromalacia using preserved scleral graft with amniotic membrane transplantation. Cornea. 2003;22(4): 288-93.
- Enzenauer RW, Enzenauer RJ, Reddy VB, Cornell FM, West S. Treatment of scleromalacia perforans with dura mater grafting. Ophthalmic Surgery. 1992;23(12): 829-832.
- Ma DH-K, Wang S-F, Su W-Y, Tsai RJ-F. Amniotic membrane graft for the management of scleral melting and corneal perforation in recalcitrant infectious scleral and corneoscleral ulcers. Cornea. 2002;21(3): 275-283.
- Jones GL, Ponzin D, Pels E, Maas H, Tullo AB, Claerhout I. European eye bank association. Dev Ophthalmol. 2009;43: 15-21.
- Lee JS, Shin MK, Park JH, Park YM, Song M. Autologous advanced tenon grafting combined with conjunctival flap in scleromalacia after pterygium excision. J Ophthalmol. 2015; 2015: 547276.
- Mehta J, Franks W. The sclera, the prion, and the ophthalmologist. Br J Ophthalmol. 2002;86(5):587-592.
- Tullo AB, Buckley RJ, Kelly T, Head MW, Bennett P, Armitage WJ, et al. Transplantation of ocular tissue from a donor with sporadic Creutzfeldt–Jakob disease. Clin Exp Ophthalmol. 2006;34(7): 645-649.
- Thakur S, Ichhpujani P, Kumar S. Grafts in glaucoma surgery: a review of the literature. Asia Pac J Ophthalmol (Phila). 2017;6(5): 469-476.
- Alaminos M, Sánchez-Quevedo MaDC, Munoz-Ávila JI, Serrano D, Medialdea S, Carreras I, et al. Construction of a complete rabbit cornea substitute using a fibrin-agarose scaffold. Invest Ophthalmol Vis Sci. 2006;47(8):3311-3317.
- Carriel V, Garzón I, Jiménez J-M, Arias-Santiago S, Campos A, Sánchez-Quevedo M-C, et al. Epithelial and stromal developmental patterns in a novel substitute of the human skin generated with fibrin-agarose biomaterials. Cells Tissues Organs. 2012;196(1):1-12.
- Chato-Astrain J, Campos F, Roda O, Miralles E, Durand-Herrera D, Sáez-Moreno JA, et al. In vivo evaluation of nanostructured fibrin-agarose hydrogels with mesenchymal stem cells for peripheral nerve repair. Front Cell Neurosci. 2018;12: 501.
- González-Andrades M, Mata R, del Carmen González-Gallardo M, Medialdea S, Arias-Santiago S, Martínez-Atienza J, et al. A study protocol for a multicentre randomised clinical trial evaluating the safety and feasibility of a bioengineered human allogeneic nanostructured anterior cornea in patients with advanced corneal trophic ulcers refractory to conventional treatment. BMJ open. 2017;7(9): e016487.
- Carriel V, Scionti G, Campos F, Roda O, Castro B, Cornelissen M, et al. In vitro characterization of a nanostructured fibrin agarose bio‐artificial nerve substitute. J Tissue Eng Regen Med. 2017;11(5):1412-1426.
- Campos F, Bonhome-Espinosa AB, García-Martínez L, Durán JD, López-López MT, Alaminos M, et al. Ex vivo characterization of a novel tissue-like cross-linked fibrin-agarose hydrogel for tissue engineering applications. Biomed Mater. 2016;11(5):055004.
- Carriel V, Vizcaíno-López G, Chato-Astrain J, Durand-Herrera D, Alaminos M, Campos A, et al. Scleral surgical repair through the use of nanostructured fibrin/agarose-based films in rabbits. Exp Eye Res. 2019:107717.
INFORMACIÓN SOBRE EL ARTÍCULO
Autor para la correspondencia: Francisco Manuel Hermoso Fernández. Hospital Clínico San Cecilio. Avda. Ilustración, 1. 18016 Granada, España. E-mail: framaherfer@gmail.com