Revisión
Matrices para Ingeniería del tejido óseo
Scaffolds for bone tissue engineering
Actual. Med. 2019; 104: (806): 36-45 DOI: 10.15568/am.2019.806.re01
Enviado: 07-03-2019
Revisado: 13-04-2019
Aceptado: 16-04-2019
RESUMEN
La patología que afecta al tejido óseo puede generar defectos irreversibles que no son capaces de regenerar por sí solos. Las opciones terapéuticas actuales están basadas en técnicas de trasplante de tejido óseo vivo, tanto autólogo como heterólogo. Sin embargo, estas opciones tienen asociados problemas de morbilidad, inmunogenicidad y disponibilidad. En este sentido, la Ingeniería Tisular supone, mediante la elaboración de constructos celulares, una nueva opción terapéutica que pretende mejorar los enfoques actuales. Las características especiales del tejido óseo requieren de una elección adecuada del biomaterial que se emplee como matriz del constructo celular como sustituto óseo.
En este artículo se expone una revisión de los diferentes biomateriales que se han empleado hasta la actualidad como matrices para la ingeniería tisular del tejido óseo, así como sus principales características y propiedades en relación con la matriz ósea.
Actualmente no existe una traslación clínica completa y existen publicados 26 casos clínicos al respecto. Queda pendiente el aumento del número de ensayos clínicos en diferentes fases, la aprobación de algunas técnicas para nuevas aplicaciones clínicas y un seguimiento extenso y riguroso de la evolución de las mismas. Es fundamental unir todos los esfuerzos para optimizar la selección de materiales y procesos adecuados, y consolidar una base apropiada de conocimientos que permita encontrar para cada aplicación clínica la matriz más adecuada que permita la adecuada regeneración ósea.
Palabras clave: Ingeniería tisular ósea; Regeneración ósea; Tejido óseo; Matrices
ABSTRACT
Bone tissue pathology can generate irreversible defects that are not capable of regenerating by themselves. The current therapeutic approaches are based on native bone tissue grafts, either autologous or heterologous. However, these clinical approaches are commonly associated to morbidity, immunogenicity and availability. In this sense, Tissue Engineering allows, through the development of cellular constructs, a new therapeutic approach that aims to improve current ones. The specific properties of the bone tissue require an adequate selection of biomaterials used as a scaffold of the cellular construct as a bone substitute.
This work presents a review of the different biomaterials that have been reported up today as a scaffold for bone tissue engineering, as well as its main characteristics and properties in relation to the bone matrix.
Currently, there is no full clinical translation and there are up to 26 clinical trials published in this regard. The increase in the number of clinical trials in different phases, the approval of some techniques for new clinical applications and an extensive and rigorous follow-up of their evolution are pending. It is important to gather efforts to optimize the selection of appropriate materials and techniques, and consolidate an appropriate knowledge base that allows finding for each clinical application the most appropriate scaffold that allows adequate bone regeneration.
Keywords: Bone tissue engineering; Bone regeneration; Bone tissue; Scaffolds
Leer Artículo Completo
INTRODUCCIÓN
Un gran número de enfermedades y lesiones así como todo tipo de traumatismos pueden provocar daños y degeneración, no reversibles, de los diferentes tejidos del cuerpo humano, lo que requiere diferentes tratamientos médicos y quirúrgicos que hagan posible su reparación, reemplazo o regeneración (1).
En el caso del tejido óseo (TO), las afirmaciones anteriores son especialmente válidas pues son frecuentes las enfermedades que le afectan, como fracturas óseas, tumores, escoliosis, osteoporosis, infecciones óseas, lumbalgias y enfermedades reumáticas, muchas de las cuales producen lesiones que la propia regeneración ósea no puede resolver. Es previsible una evolución ascendente de los casos de insuficiencia ósea en el futuro debido al aumento de la obesidad, el envejecimiento progresivo de la población por el aumento de la esperanza de vida, y el escaso ejercicio físico realizado por muchas personas (2), siendo el hueso el segundo tejido más trasplantado en todo el mundo, con al menos cuatro millones de operaciones anuales que emplean injertos o sustitutos óseos (3).
Los tratamientos óseos restauradores consisten por lo general en el trasplante de tejidos de un sitio a otro en el mismo paciente (autoinjertos) o, cuando ello no es posible, de un individuo a otro (alotrasplante o aloinjerto), y a veces incluso a partir de animales de otra especie (xenotrasplante). Por sus complicaciones de rechazo y dificultades de implantación, esta tercera modalidad es irrelevante para la mayoría de las necesidades médicas y también para las relacionadas con los defectos óseos, aunque existen estudios que emplean hueso bovino desproteinizado (4) o injertos derivados de mineral de hueso bovino (5).
Por la escasez de donantes compatibles tampoco existe buena disponibilidad de los tejidos necesarios para estas reparaciones. El autotrasplante también está limitado en muchas ocasiones pues los tejidos que podrían cambiar de localización en el mismo paciente suelen ser insuficientes o están afectados en grado similar a las porciones que se pretenden sustituir.
Todo ello lleva a la necesidad de generar sustitutos para estos tejidos naturales degenerados o dañados y ese es precisamente el objetivo de la Ingeniería Tisular. Más que un simple reemplazo, trata de regenerar los tejidos dañados, a veces a partir de unas pocas células, desarrollando sustitutivos biológicos que restauren, mantengan o mejoren la función del tejido natural, en este caso, el hueso.
El TO se caracteriza por presentar componentes de naturaleza orgánica, como colágeno, factores de crecimiento, osteonectina, proteoglicanos y proteínas morfogenéticas del hueso (BMP) (6), junto a componentes inorgánicos, fundamentalmente cristales de hidroxiapatita (HA) en los que abundan los iones fosfato, carbonato, citrato y fluoruro junto a los cationes calcio, magnesio y sodio, formando la matriz extracelular (MEC) sobre la que se desarrollan las células específicas de este tejido: osteoblastos, osteocitos y osteoclastos (7).
Aunque el hueso sano es el único tejido con buenas cualidades regenerativas, una discontinuidad o defecto en la integridad ósea, resultante de traumatismo, malformación congénita o resección quirúrgica, si supera cierto tamaño crítico, no se regenerará espontáneamente y, por lo tanto, requerirá otras intervenciones médico-quirúrgicas (8). Ello es debido en parte a sus características peculiares que lo diferencian del resto de tejidos del cuerpo, como su dureza, rigidez y limitada flexibilidad, su constitución a base de tejido conjuntivo altamente mineralizado, muy vascularizado e inervado, y su estructura en laminillas que forman la matriz ósea calcificada (9).
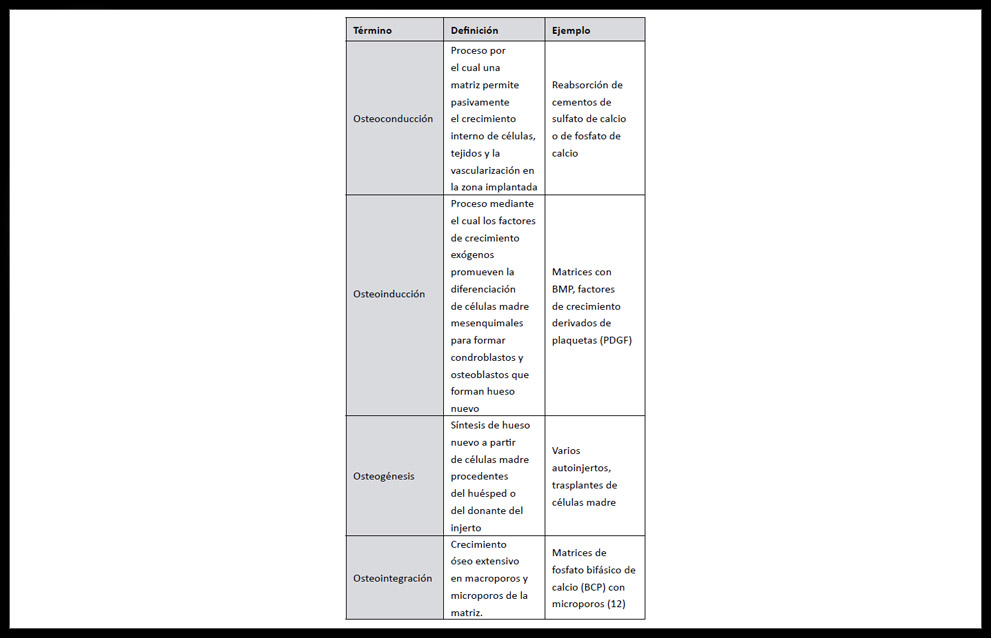
Los trasplantes autogénicos emplean injertos óseos del propio paciente y son la herramienta terapéutica fundamental disponible actualmente, presentando importantes ventajas por ser histocompatibles y no inmunogénicos. Poseen todas las propiedades necesarias requeridas a un material de injerto óseo (osteoconducción, osteoinducción, osteogénesis) (10), (ver tabla 1) debido a la presencia de células osteoprogenitoras propias, BMP y otros factores de crecimiento, junto a la matriz porosa tridimensional que facilitará el desarrollo y ensamblaje celular, así como colágeno tipo I que favorece la vascularización y la integración biológica definitiva (11).
Tabla 1. Definición de términos y algunos ejemplos referidos a desarrollo y regeneración óseas (13)
Además, los aloinjertos presentan algunos defectos, limitaciones y complicaciones que conviene señalar, como la necesidad de una segunda operación en el sitio de la extracción, lo que conlleva procedimientos quirúrgicos costosos que pueden ocasionar lesiones y morbilidad importantes. Tampoco son adecuados tampoco cuando el defecto requiere volúmenes de hueso mayores de lo disponible, o el estado funcional del hueso en la zona donante no es adecuado (14).
La segunda técnica más común de injerto óseo consiste en trasplantar TO de un donante vivo o de un cadáver. Los aloinjertos son seleccionados para que sean histocompatibles, y posteriormente desvitalizados mediante irradiación o son procesados hasta hacerlos disponibles en varias formas (congelados, liofilizados, desmineralizados) según los requisitos de la zona a reparar, por lo que sus propiedades iniciales osteoinductivas quedan reducidas. Pueden producir reacciones inmunes y transmitir infecciones, presentan costes elevados y, debido a la gran demanda, actualmente existe escasez de estos elementos para regeneraciones óseas.
Otras técnicas de reparación ósea comúnmente utilizadas son los implantes metálicos a base de aleaciones de titanio y acero inoxidable, muy usadas en prótesis articulares, placas y tornillos, pues permiten proporcionar soporte mecánico y estructural para artroplastias de articulaciones y fracturas de huesos largos y vértebras pero presentan limitaciones debido a la no degradabilidad, alta rigidez, posible fractura, falta de integración con el tejido del huésped, y posibles infecciones (15).
Pueden citarse también la osteogénesis por distracción (16), y los rellenos de cemento y BMP (17), que mejoran la reparación ósea pero carecen del potencial osteoinductivo y angiogénico adecuados, presentan seguridad biológica limitada y otros inconvenientes en términos de morbilidad del paciente, vida útil y costes.
La regeneración de estos defectos óseos de dimensiones críticas y la mejora de la disponibilidad de injertos para todas las necesidades han llevado a buscar otras terapias clínicamente eficaces, como las basadas en la Ingeniería Tisular, durante los últimos veinte años (8).
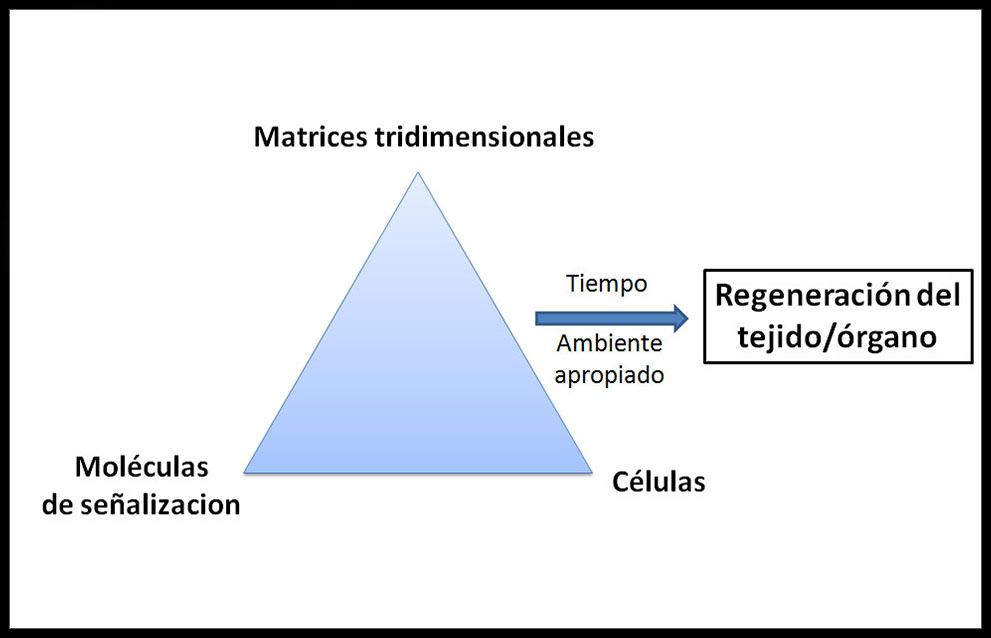
La construcción de estos nuevos tejidos se basa, de modo general, en la conjunción de tres elementos necesarios, que forman la llamada “tríada de la Ingeniería Tisular”: (Figura 1)
Figura 1: Triángulo o Tríada de elementos de la Ingeniería Tisular (18)
a) andamiajes tridimensionales o matrices (scaffolds) construidas en ciertos biomateriales de adecuada porosidad, que proporcionan el soporte y entorno de crecimiento adecuado,
b) células de la tipología elegida capaces de replicarse y/o diferenciarse dentro de la matriz elegida hasta formar los órganos y tejidos requeridos,
c) factores de crecimiento, que son proteínas u hormonas de origen natural que estimulan la diferenciación, proliferación y crecimiento celulares, como el factor de crecimiento transformante beta (TGF-β) o los factores de crecimiento similares a la insulina (IGF-1 e IGF-2). A veces pueden ser acompañados o sustituidos por estímulos biofísicos adecuados en el biorreactor, que inducen la evolución celular, inicialmente in vitro, hasta la implantación en el lugar adecuado (19).
Dichas combinaciones de matrices, células, junto a moléculas y señales inductoras reciben el nombre de “constructo celular”.
El presente artículo aborda una revisión de la literatura científica aparecida en los últimos años en las revistas del área sobre el desarrollo de matrices para constructos de tejido óseo (MCTO). Se analizarán las características esenciales de estas estructuras, los avances recientes en su diseño y aplicación clínica, junto a la posible evolución de las mismas y algunos aspectos que aun deberían mejorarse.
2. Síntesis de la revisión
En las aplicaciones de ingeniería tisular ósea (ITO), la matriz tridimensional artificial es el entorno en que van a desarrollarse las células hasta conformar los nuevos tejidos sustitutivos. Por ello han de poseer un parecido elevado, en cuanto a estructura y propiedades, con la MEC ósea.
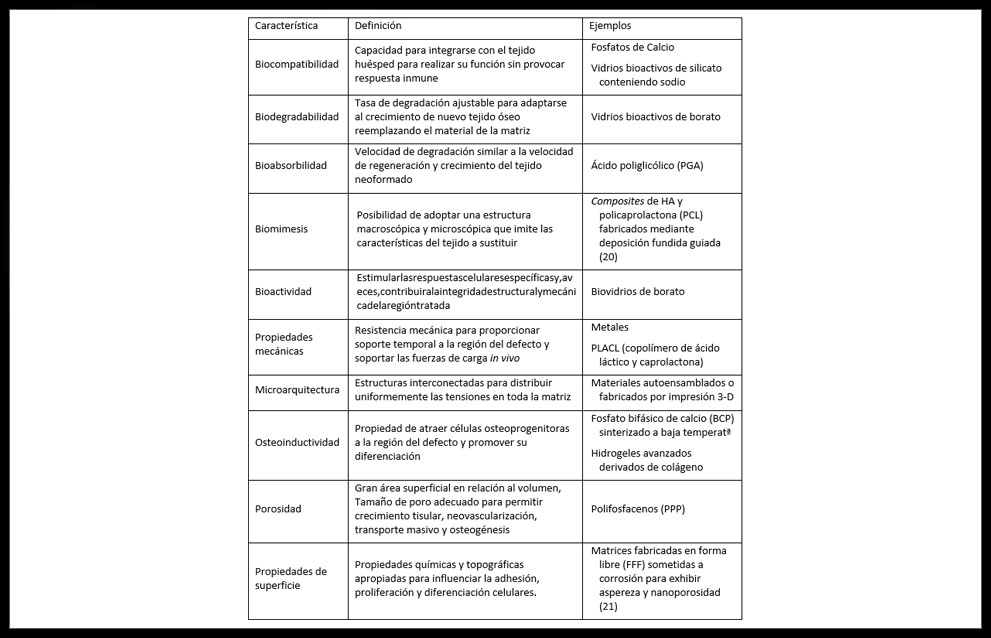
Una MCTO ideal debería poseer algunas propiedades básicas (Tabla 2) y cumplir los objetivos de la regeneración ósea artificial: permitir o mejorar la viabilidad celular, favorecer la unión, la proliferación y la ubicación espacial de dichas células, permitir la diferenciación osteogénica, la vascularización, la integración con el huésped y, cuando sea necesario, soportar la carga mecánica adecuada (14)
Tabla 2: Algunas características para el diseño de matrices para aplicaciones de ITO (22)
2.1. Características principales de las matrices usadas en ITO
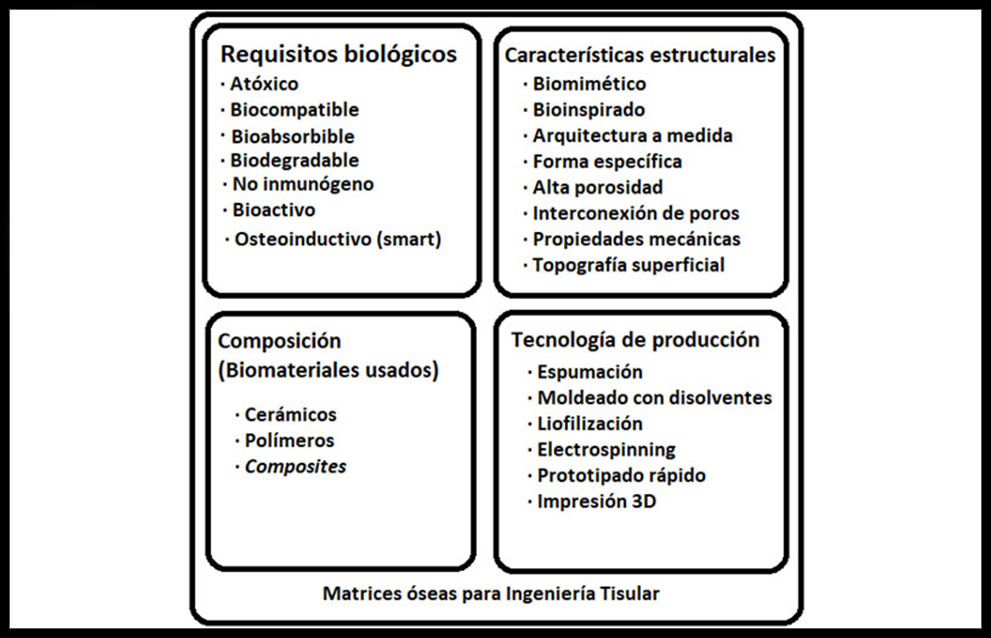
Las propiedades que pueden ser moduladas, mejoradas o cambiadas para hacer una MCTO adecuada se pueden agrupar en cuatro bloques. (Figura 2)
Figura 2: Características ideales de las matrices usadas en el desarrollo de aplicaciones de ingeniería de tejido óseo (ITO) (23)
2.1.a) Requisitos biológicos.
Las matrices empleadas deben carecer de toxicidad para las células y su material genético, permitir la integración adecuada con el tejido huésped (biocompatibilidad) sin causar una respuesta inmune.
Deben poseer tasas de reabsorción que sean similares a las de formación ósea de tal manera que puedan degradarse y ser progresivamente sustituidas por el tejido natural regenerado, deben ser capaces de presentar o liberar moléculas bioactivas que interactúen positivamente con los tejidos y órganos próximos, favoreciendo la migración y diferenciación celular, y orientar la función de las células de su microentorno para formar hueso nuevo (osteoinducción) (23; 24).
2.1.b) Características estructurales.
El contacto entre el biomaterial de la matriz y las células óseas debe permitir interacciones biológicamente activas (biomimesis) entre ambos (25). Las arquitecturas inspiradas en diseños naturales facilitan la funcionalidad, el crecimiento celular y la vascularización. Las MCTO tendrán una arquitectura específica adaptada y podrán adoptar la forma requerida por cada necesidad biológica. Deben presentar poros de 300 a 500 μm de diámetro aproximado, interconectados a escala micrométrica, pues una elevada porosidad es necesaria para la difusión de gases y nutrientes, la eliminación de los desechos metabólicos celulares, para permitir la infiltración y migración celulares así como la angiogénesis, mientras un área superficial aumentada, proporcionada por poros pequeños, puede tener un efecto beneficioso sobre la adhesión celular, afectando a la morfología y diferenciación celulares (19).
Las MCTO estarán diseñadas para que sus propiedades mecánicas coincidan con las del hueso esponjoso humano que tiene una resistencia a la compresión entre 2 y 12 MPa y un módulo elástico entre 0,1 y 5 GPa (26). Su estructura y topografía superficial permitirán la incorporación de moléculas bioactivas naturales o artificiales (factores de crecimiento, fármacos antiinflamatorios, etc.) que se liberarán en ese microentorno después de la implantación celular o tras el injerto en la zona huésped (23).
2.1.c) Composición de los biomateriales.
Los materiales usados para MCTO son muy diversos y podrían clasificarse inicialmente, por su origen, en soportes naturales y sintéticos. Los de origen natural presentan la ventaja de ser biocompatibles, biodegradables, y favorecer la migración y adhesión celulares (27).
Los biomateriales de origen sintético presentan mayor facilidad de manejo, podrían obtenerse finalmente en mayores cantidades, pero presentan cierta toxicidad relacionada con su proceso de degradación (28) y son menos biocompatibles con las células.
Por su estructura y composición química, pueden clasificarse en grandes grupos: cerámicas, polímeros naturales y sintéticos, materiales compuestos (composites), y, en menor medida, metales.
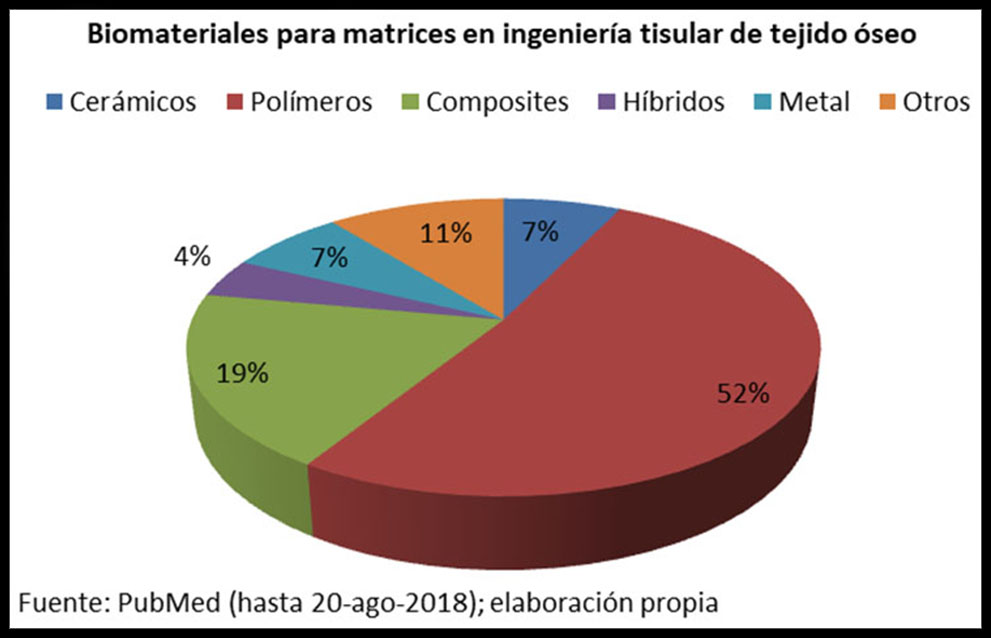
Un estudio de 5.900 artículos que aparecen en inglés en la base PubMed hasta agosto de 2018 muestra la siguiente distribución de biomateriales presentes en las MCTO. (Figura 3)
Figura 3: Biomateriales presentes en las matrices usadas en aplicaciones de ITO, según artículos presentes en PubMed hasta 20-agosto-2018.
Materiales cerámicos
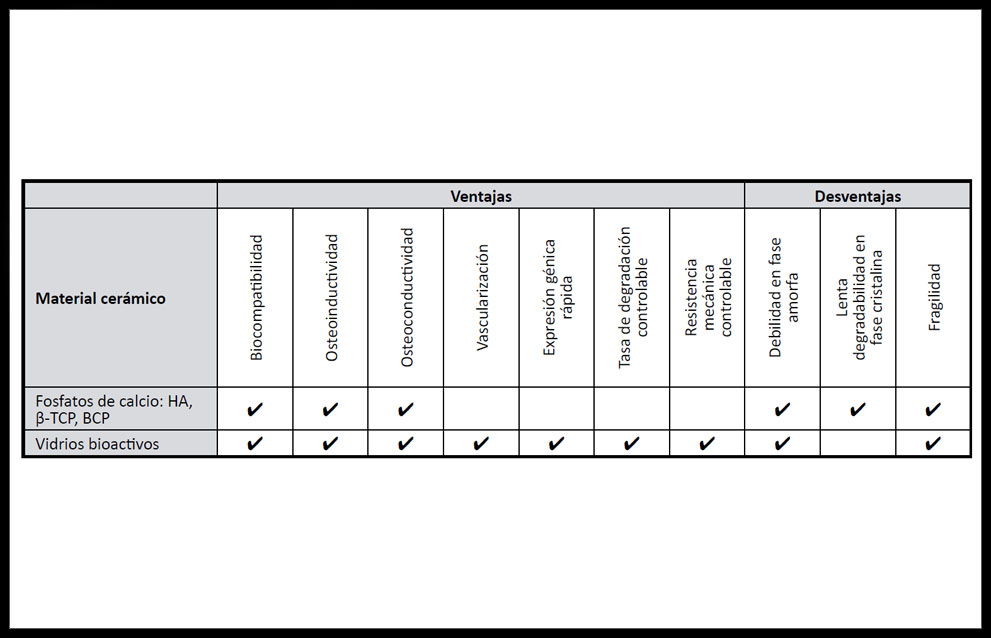
Las cerámicas son compuestos inorgánicos formados a altas temperaturas que contienen elementos metálicos y no metálicos, con estructura cristalina, como alúmina, zirconio, hidroxiapatita (HA), y fosfatos de calcio (FC). A este grupo pertenecen también los vidrios, compuestos sólidos inorgánicos formados a altas temperaturas con una estructura amorfa, como algunos vidrios bioactivos con borato. Son estables termodinámicamente, pueden ser osteoinductivos pero su tasa de degradabilidad es baja. (Tabla 3)
Tabla 3. Ventajas y desventajas de materiales cerámicos usados en ITO. (33, 34)
El sulfato de calcio, la hidroxiapatita y otras variedades de FC han sido muy usados para MCTO por su similitud con los componentes de la MEC ósea natural aunque solo presentan propiedades osteoconductivas (29). Si bien el fosfato de tricalcio beta (β-TCP) es biorreabsorbible, la hidroxiapatita es el FC más similar a la fase mineral ósea.
Tienen buenas características osteoinductivas las matrices derivadas de β-TCP(30, 31),que pueden aplicarse en forma de cerámicas sinterizadas, cerámicas derivadas de coral, cementos o recubrimientos(14)y el fosfato bifásico de calcio (BCP) sinterizado a baja temperatura. (32)
Polímeros
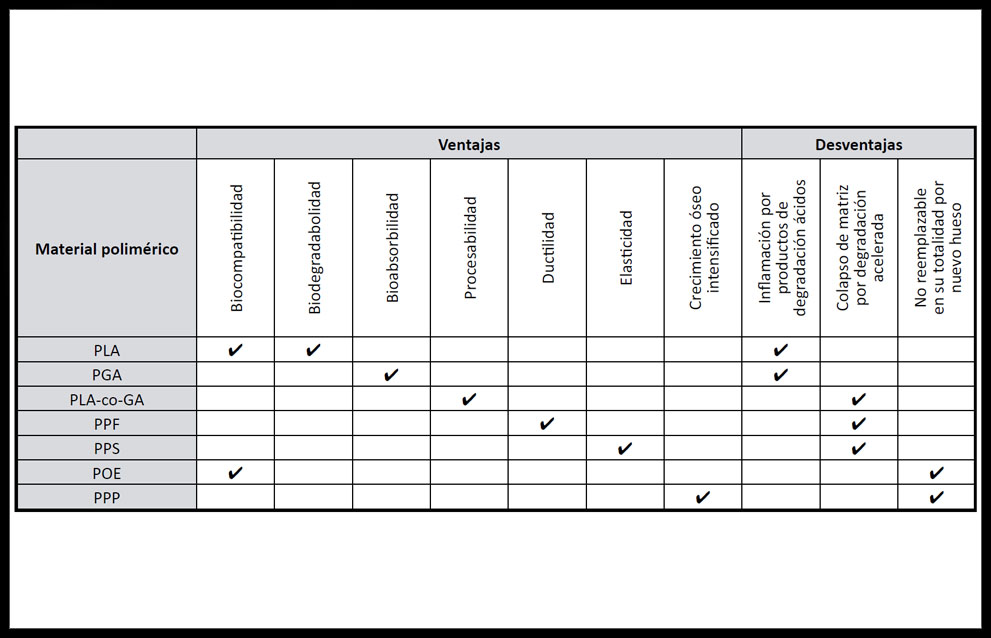
Los materiales más usados en MCTO son los polímeros naturales y sintéticos (proteínas, termoplásticos, hidrogeles, elastómeros), que aparecen en más de la mitad de los trabajos de investigación publicados sobre ITO. Entre los de origen natural se usan materiales como ácido hialurónico, fibrina, heparina, quitosano, alginato, agarosa, colágeno, gelatinas, fibroína de seda, quitina y otros materiales biológicos.(27)Entre los polímeros sintéticos usados encontramos ácido poliláctico (PLA), ácido poliglicólico(PGA), poli-ε-caprolactona (PCL), fumarato de polipropileno (PPF), poliuretano poroso (PPS), poliortoésteres (POE) y plasma pobre en plaquetas (PPP), con diferentes propiedades mecánicas en cuanto a elasticidad, ductilidad y biorreabsorbilidad por lo que cada uno de ellos presenta ventajas y desventajas específicas. (Tabla 4)
Tabla 4. Ventajas y desventajas de materiales poliméricos usados en ITO. (33, 34)
Dada la excesiva rigidez y poca flexibilidad de PGA, PCL y PLA, polímeros muy usados, se han copolimerizado con otros materiales para mejorar esas propiedades, dando lugar a materiales elastoméricos con mejores características mecánicas y de biodegradación: ácido poliláctico copolimerizado con ácido glicólico (PLGA ó PLA-co-GA); así como copolímeros binarios de los primeros con policaprolactona, PCL-co-GA y PCL-co-LA (34).
Metales
Los metales, utilizados desde hace mucho para reparaciones óseas, también se han explorado como biomateriales en matrices porosas que permitan la regeneración del tejido óseo. Pueden citarse las matrices de tántalo o Ti6Al4V fundidas con láser, capaces de promover la adhesión y la diferenciación de las células osteoprogenitoras (35), y los implantes de titanio fabricados aditivamente con riesgo reducido de infección a través de la incorporación de nanopartículas de plata en un revestimiento superficial de óxido (36).
Tienen excelentes propiedades mecánicas y estabilidad estructural pero su rigidez es mucho mayor que la del hueso natural lo que puede reducirse a veces aumentando la porosidad, pero su mayor limitación es la no degradabilidad, seguida del riesgo de infección y la falta de integración con el tejido del huésped (2).
Materiales compuestos (composites)
Las matrices compuestas o composites se diseñan con el objetivo de aprovechar las propiedades clave de al menos dos clases de materiales. Los polímeros naturales o sintéticos a menudo se combinan con componentes inorgánicos, como cerámicas de FC o biovidrios (37). Aproximadamente el 10% de las matrices se construyen con estos diseños, por ejemplo al mezclar la excelente resistencia mecánica y biodegradabilidad de la fibroína de seda con la bioactividad de un biovidrio a base de sílice en películas compuestas (38); o la HA con el polisacárido quitosano (39).
Aparte de los composites polímero-cerámicos, existen combinaciones de cerámicas con metales y, en menor medida, polímeros con metales.
Los composites de alginato de sodio, silicato de calcio y fibroína de seda tienen buena tasa de biodegradación, citocompatibilidad y bioactividad, y sus propiedades mecánicas y porosidad pueden controlarse ajustando el contenido de silicatos (40).
Tienen buenas propiedades osteoinductivas los combinados de HA con polímeros de ácido poliláctico y ácido poliglicólico (PLGA) (14).
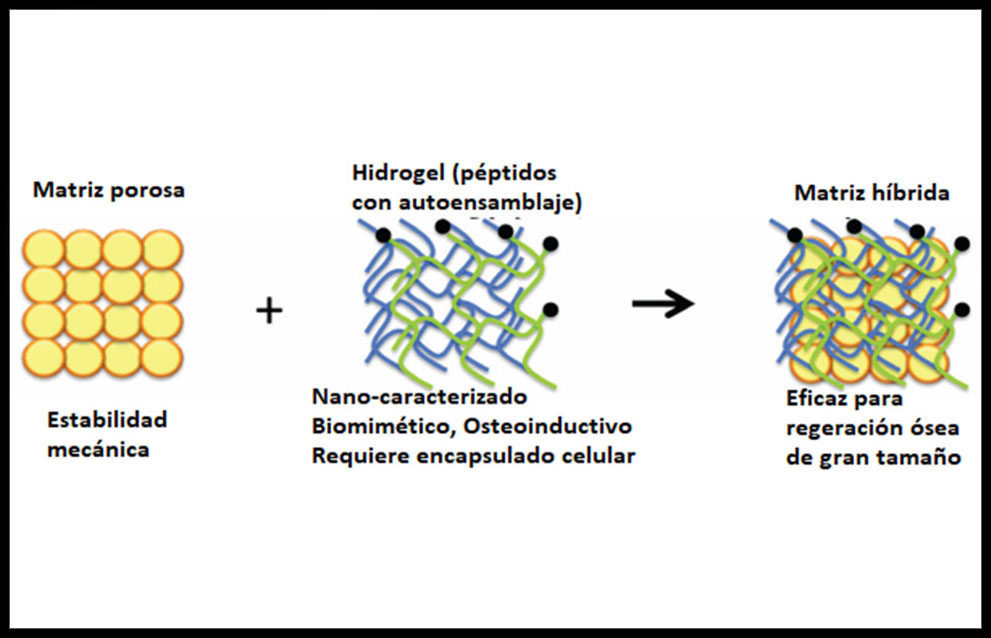
A veces se consideran los materiales híbridos como un grupo aparte de biomateriales pero en realidad solo se diferencian de los composites en el grado de mezcla de los elementos que se combinan. (Figura 4)
Figura 4: Estructura y funciones de una matriz porosa, una matriz de hidrogel y una matriz híbrida o compuesta (14)
2.1.d) Tipos de procesos de fabricación
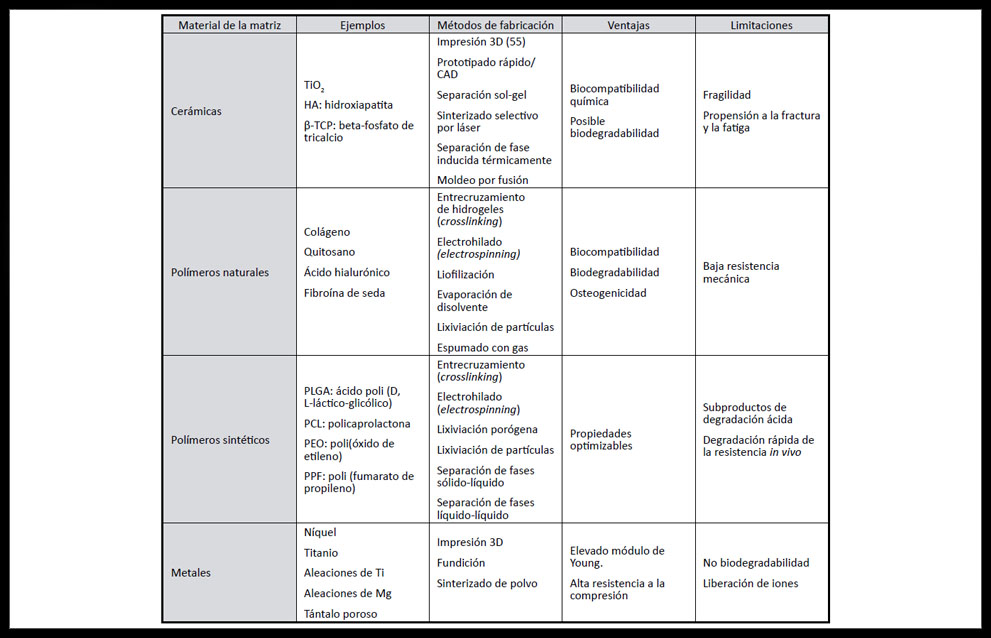
Entre las características fundamentales de las MCTO destacan la adecuada porosidad y esto se consigue a través de diversas técnicas como el espumado mediante gas (gas foaming), la liofilización, la evaporación de disolvente (solvent casting), la lixiviación porógena (porogen leaching), la lixiviación mediante partículas, el entrecruzamiento (crosslinking), la fabricación libre (freeform fabrication, FFF), y la separación de fases líquido-líquido térmicamente inducida (14, 41).
Es muy importante controlar el tamaño y la interconexión de los poros, a diferentes escalas, y la mayoría de las técnicas anteriores no permiten controlar eso por lo que se han diseñado combinaciones de las mismas (Tabla 5), o el uso de otras técnicas como el electrohilado (electrospinning), el prototipado rápido (42), la impresión 3-D, y el autoensamblado molecular (33).
(Tabla 5)
Tabla 5. Resumen de materiales y técnicas utilizadas para fabricar matrices de ingeniería de tejidos óseos con sus principales ventajas y limitaciones (2)
2.2 Avances recientes en el diseño de MCTO
Ningún biomaterial actual para formar matrices y constructos puede considerarse definitivo como capaz de regenerar hueso frente a los autoinjertos y aloinjertos, puesto que no han alcanzado niveles óptimos frente a la adhesión, proliferación, migración o propiedades mecánicas. Se continúa el esfuerzo de mejorar los materiales existentes yse han producido avances en la creación de otros nuevos:
a) copolímeros glicólidos o láctidos de PCL, un elastómero en el que cadenas amorfas de PCL proporcionan segmentos suaves y el PLA proporciona bloques duros debido a su fuerte reticulación (33).
b) polihidroxialcanoatos, que presentan buena elasticidad, y mejor adhesión, proliferación y migración celular que PLLA (34).
c) poliuretano, muy usado para todo tipo de aplicaciones médicas, con buena tolerancia para las células estromales de médula ósea, probada en diferentes modelos animales y cultivos celulares humanos (43). Entre sus limitaciones están la toxicidad de sus productos de degradación, potencialmente cancerígenos, y su alto tiempo de reabsorción. Podría sustituirse por polisebacato de poliol (PPS), polisebacato de xilitol (PXS) y polisebacato de glicerol (PGS) para superar así estos inconvenientes (44).
d) Biovidrios ricos en borato y sodio, muy biodegradables, capaces de promover nueva mineralización en el hueso pero con pobres propiedades mecánicas que se están estudiando mejorar. El 45-S5 Bioglass® es un producto comercial clásico con altísima adhesión al hueso y buena tasa de degradación pero de difícil procesado en forma de fibras (45), que está dando paso progresivamente a biovidrios con borato, capaces de convertirse en HA a mayor velocidad que aquellos ricos en silicio, y con mayor osteoconductividad.
Las nuevas líneas de investigación están centradas en materiales osteoinductivos (smart) como algunos derivados de FC; materiales híbridos (copolímeros, mezclas de polímeros y composites cerámico-poliméricos); ciertos hidrogeles avanzados derivados de colágeno, gelatina, polivinilalcohol (PVA), polietilenglicol, poli(aldehído guluronato) (PAG), tereftalato de polietilenglicol (PET) y tereftalato de polibutileno (PBT) (45); materiales de estructura compleja como las matrices bioactivas compuestas de HA/PCL con estructura anatómica similar al hueso; y matrices fabricadas mediante deposición fundida guiada por tomografía computerizada, con liberación espaciotemporal de citoquinas duales (20).
Una mención aparte merecen los materiales inmunomoduladores, capaces de aumentar la apoptosis de macrófagos humanos primarios adheridos y los niveles de citoquina antiinflamatoria IL-10, y de disminuir los niveles de quimiocina asociada a inflamación IL-8, la fijación de células pasivas y la adhesión inicial de monocitos. Estudios in vivo han demostrado aumento de la infiltración celular, disminución de la cápsula fibrosa, posibilidad de incorporación de moléculas bioactivas y medicamentos antiinflamatorios, a la vez que proporcionan sitios de adhesión de integrinas, disminuyen la inmunidad dirigida de linfocitos Th1, aumentan la activación de macrófagos, y la adhesión y proliferación celulares (14).
2.3 Aplicaciones clínicas actuales
La mayor parte de la investigación sobre MCTO se encuentra todavía en estadios de ciencia básica y no son muy abundantes los ensayos y aplicaciones clínicas sobre regeneración ósea mediante ITO. En uno de estos ensayos se trasplantaron células autólogas humanas, obtenidas a partir de aspirados de médula ósea, que tras ser aisladas, cultivadas y caracterizadas, fueron absorbidas en una esponja de gelatina que se trasplantó al sitio de extracción y se cubrió con una membrana de barrera de colágeno bioabsorbible. Seis semanas después, una biopsia del sitio regenerado reveló una formación de tejido óseo mineralizado altamente vascularizado (46). Sin embargo, estudios posteriores de ensayos parecidos mostraron que a medio plazo se producía osteólisis y osificación heterópica (47).
También se han obtenido resultados prometedores en el trasplante de células madre de médula ósea autóloga humana para corregir defectos del paladar, aumentos del seno maxilar y tratamiento de fracturas de huesos largos encontrándose una aceleración estadísticamente significativa de la curación de fracturas en el grupo experimental sin reacciones inflamatorias significativas o efectos adversos graves (6). Las matrices empleadas eran de sulfato de calcio con hueso desmineralizado.
Se han realizado algunos ensayos clínicos en fases I y II, como el autotrasplante local de células CD34+ suspendidas en gel de aterocolágeno en pacientes con seudoartrosis tibial o femoral, obteniéndose curación radiológica de fracturas a las 12 semanas en un 71,4% de pacientes, muy por encima del estándar sin ese tratamiento (48).
En general son poco numerosos los estudios clínicos reportados, solo 26 de un total de 8.041 artículos que aparecen en PubMed sobre ITO con las palabras de búsqueda “bone tissue engineering scaffolds” y solo pertenecen a las fases I y IIa. Los ensayos más numerosos pertenecen al área odontológica como el trasplante autólogo de epitelio cultivado en membrana amniótica y PLLA para cubrir pérdida de tejido no cicatricial en casos seleccionados(49), y suelen tener mejores resultados a corto que a medio plazo como en el ensayo clínico controlado aleatorizado de preservación ósea después de la extracción del tercer molar maxilar usando composites porosos de PLGA / HA / β-TCP, con y sin simvastatina, donde se produjo escaso porcentaje de curación y aparecieron complicaciones (50).
Las muestras de pacientes suelen ser reducidas salvo algunos ensayos de regeneración ósea en que se superan los 60 individuos como el estudio aleatorizado y controlado de implantación de un composite de hidroxiapatita porosa / colágeno tipo 1 con mejores resultados que el β-TCP comercial, aunque en este caso se implantó solo la matriz porosa y no un constructo de ITO propiamente dicho (51).
Todo ello lleva a algunos autores a la afirmación de que la ITO estaría actualmente pasando por el “valle de la muerte” que aparece en muchos campos de investigación, una vez superados los primeros escollos de falta de conocimiento, debido a la falta de fondos para superar los ensayos preclínicos y las dificultades regulatorias hasta su aprobación y uso clínico regular (52). Si bien es difícil imitar a la naturaleza, los hallazgos científicos y tecnológicos recientes muestran potencial para lograr matrices óseas que cumplan finalmente las funciones biológicas locales y sistémicas (53).
2.4 Limitaciones y retos de futuro
La necesidad desuperar la eficacia clínica de los injertos óseos alogénicos ha tenido un éxito limitado hasta ahora, porque las expectativas depositadas en la ingeniería tisular en su conjunto están teniendo aun un resultado más simbólico que real (8).
Se constituye como un auténtico dilema el desarrollo de un biomaterial para MCTO que posea la suficiente resistencia mecánica pero que simultáneamente tenga adecuada biodegradabilidad pues ambas propiedades tienen comportamientos antagónicos. Los metales, apatitas y polímeros cristalinos poseen una gran resistencia mecánica, pero no son biodegradables; en cambio, las apatitas amorfas y los biovidrios presentan buena degradabilidad pero no tienen buena resistencia mecánica (34).
Sin duda los mayores retos pendientes de la ITO están en el campo de la Ingeniería de materiales, más que en aspectos de biología celular o molecular, pero no son los únicos. Hasta ahora, la mayoría de los esfuerzos para superar la eficacia de autoinjertos y aloinjertos no han tenido éxito. Aunque ha habido algunas manifestaciones exitosas de estos enfoques en la clínica, aun no se han conseguido resultados reales aplicables (54).
Debería finalmente conseguirse una elección efectiva de la combinación a aplicar en cada caso, el tipo de células madre, la matriz de mecánica y porosidad compatibles, y los factores de crecimiento o biomoléculas coadyuvantes (55); para lograr la vascularización adecuada y la integración perfecta en la zona huésped; controlando las reacciones inmunes mediante biomateriales y/o agentes inmunomoduladores apropiados y evitando los posibles efectos secundarios y complicaciones que puedan surgir; para conseguir buena calidad y funcionalidad del hueso regenerado (56).
Para ello debe seguirse profundizando en la adquisición de conocimiento básico, la elección de los mejores modelos animales, aumentar el número de ensayos clínicos, profundizar en la evaluación de los mismos y en el seguimiento a largo plazo del hueso regenerado.
Por ser tratamientos muy específicos de cada paciente, la aprobación por parte de los organismos reguladores y el coste de los complejos tratamientos son también retos a superar en el futuro (14).
CONCLUSIONES
La ingeniería del tejido óseo representa un impacto muy grande en la salud pública mundial con un amplio mercado de materiales para reemplazo y reparación óseas. Es por ello que constituye posiblemente el área de investigación más activa de la ingeniería de tejidos, junto con la piel.
Aunque los injertos óseos de origen humano siguen siendo los materiales más usados para restaurar el hueso dañado, están siendo progresivamente sustituidos por biomateriales sintéticos que actúan como sustitutivos del hueso. Estos biomateriales fueron seleccionados inicialmente por sus propiedades mecánicas, como las aleaciones de titanio usadas en traumatología, pero las características que se exigen actualmente tienen mucho más que ver con sus capacidades de facilitar la regeneración ósea.
El desarrollo de la ITO lleva así a diseñar matrices bioactivas que sirvan de soporte a las células y liberen biomoléculas que actúen sobre ellas, hasta conseguir su diferenciación, el crecimiento de nuevos tejidos y la integración efectiva con las estructuras circundantes, buscando especialmente inducir la neoformación de hueso y la vascularización.
El material de la matriz para un sustituto óseo ideal, además de ser poroso, biocompatible y tener buenas propiedades mecánicas, debe permitir la adhesión, la proliferación y la maduración celulares para, progresivamente, reabsorberse una vez que el nuevo hueso se vaya formando, permitiendo que este hueso se someta a remodelación hasta su maduración definitiva, objetivo que aún no se ha logrado.
El diseño de MCTO para un uso específico requiere conocer las propiedades de los posibles materiales precursores, entre los cuales, los, vidrios bioactivos de silicio conteniendo sodio, los biovidrios con borato o dopados con elementos traza, y los derivados de HA y FC parecen ofrecer una serie de ventajas sobre otros. Es importante adaptar la microarquitectura de las matrices por la relación dual existente entre el tamaño delos poros y el comportamiento de las células, pues cambios sutiles en la arquitectura tienen efectos significativos sobre la actividad celular.
Se han producido avances en el desarrollo de nuevos materiales y combinaciones de los mismos que amplían el repertorio disponible para fabricación de MCTO pues poseen efectos beneficiosos sobre la remodelación ósea y la angiogénesis, con un riesgo de toxicidad que puede ser controlado. Estos nuevos soportes están fabricados en materiales biodegradables, con diseños biomiméticos y arquitecturas cada vez más complejas y adaptadas, con la inclusión de diferentes factores de crecimiento, biomoléculas, fármacos, y células madre. Muestran cada vez mejores propiedades, aun sin conseguir reunirlas todas ellas, pero parece próxima la superación del triple reto de la osteoconducción, osteoinducción y osteogénesis, que conducirá a la regeneración ósea incluso en defectos de tamaño crítico. Queda pendiente el aumento del número de ensayos clínicos en diferentes fases, la aprobación de algunas técnicas para nuevas aplicaciones clínicas y un seguimiento extenso y riguroso de la evolución de las mismas.
Superados estos desafíos, la ITO podrá posicionarse como la opción más viable para reparar, mantener y sustituir tejidos óseos dañados. Es fundamental unir todos los esfuerzos para optimizar la selección de materiales y procesos adecuados, y consolidar una base apropiada de conocimientos que permita encontrar para cada aplicación clínica la matriz más adecuada donde incluir células y moléculas de señalización capaces de producir la regeneración e integración buscadas.
BIBLIOGRAFÍA
- O’Brien FJ. Biomaterials & scaffolds for tissue engineering. Materials Today. 2011;14(3),88–95. doi:10.1016/s1369-7021(11)70058-x
- De Witte T-M, Fratila-Apachitei LE, Zadpoor AA, Peppas NA. Bone tissue engineering via growth factor delivery: from scaffolds to complex matrices. Regenerative Biomaterials. 2018;197–211. doi:10.1093/rb/rby013
- Turnbull G, Clarke J, Picard F, Riches P, Jia L, Han F, Li B, Shu W. 3D bioactive composite scaffolds for bone tissue engineering. Bioactive Materials. 2018;3(3):278-314, doi:10.1016/j.bioactmat.2017.10.001.
- Artas G, Gul M, Acikan I, Kirtay M, Bozoglan A, Simsek S, Yaman F, Dundar S. A comparison of different bone graft materials in peri-implant guided bone regeneration. Braz. Oral Res. [Internet]. 2018;32:e59 [consultado el 18-08-2018];. Disponible en: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1806-83242018000100250&lng=en. Epub July 10, 2018. doi:10.1590/1807-3107bor-2018.vol32.0059.
- Zhang Q, Jing D, Zhang Y, Miron RJ. Histomorphometric study of new bone formation comparing defect healing with three bone grafting materials: the effect of osteoporosis on graft consolidation. Int J Oral Maxillofac Implants. 2018;33(3):645–652. doi:10.11607/jomi.5879.
- Zigdon-Giladi H, Evron A, Geller GM, Rudich U. Recent advances in bone regeneration using adult stem cells. World Journal of Stem Cells. 2015;7(3): 630–640
- Roodman GD. Advances in bone biology: the osteoclast. Endocr Rev. 1996;17(4):308-32
- Shrivats AR, McDermott MC, Hollinger JO. Bone tissue engineering: state of the union, Drug Discov Today. 2014;19(6):781-6, doi:10.1016/j.drudis.2014.04.010
- Fernández-Tresguerres I, Alobera Gracia MA, del Canto Pingarrón M, Blanco Jerez L. Bases fisiológicas de la regeneración ósea I. Histología y fisiología del tejido óseo. Med Oral Patol Oral Cir Bucal. 2006;11:E47-51.
- Soto Góngora S &Texis González MG. Injertos óseos: Una alternativa efectiva y actual para la reconstrucción del complejo cráneo-facial. Rev Cubana Estomatol [Internet]. 2005;42(1) [consultado el 13-08-2018]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75072005000100005
- Hoexter DL, Bone Regeneration Graft Materials, Journal of Oral Implantology. 2002; 28(6):290-294.
- Lan Levengood SK, Polak SJ, Wheeler MB, Maki AJ, Clark SG, Jamison RD, & Wagoner Johnson AJ. Multiscale osteointegration as a new paradigm for the design of calcium phosphate scaffolds for bone regeneration. Biomaterials. 2010;31(13):3552–3563. doi:10.1016/j.biomaterials.2010.01.052
- Roberts TT & Rosenbaum AJ. Bone grafts, bone substitutes and orthobiologics. The bridge between basic science and clinical advancements in fracture healing. Organogenesis. 2012;8(4):114–124. doi:10.4161/org.23306
- Amini AR, Laurencin CT, Nukavarapu SP. Bone tissue engineering: recent advances and challenges. Crit Rev Biomed Eng. 2012;40(5):363–408.
- Agarwal R, García AJ. Biomaterial strategies for engineering implants for enhanced osseointegration and bone repair, Adv. Drug Deliv. Rev. 2015;94:53–62, doi:10.1016/j.addr.2015.03.013.
- Kocchiu-Cam L & Mattos-Vela MA. Distracción osteogénica: una revisión de la literatura. KIRU. 2013;10(2):166–72.
- Tortolini P. y Rubio S. Diferentes alternativas de rellenos óseos. Avances en Periodoncia e Implantología Oral. 2012;24(3)
- Estrada C, Paz AC, López LE. Ingeniería de tejido óseo: consideraciones básicas. Rev. EIA. Esc. Ing. Antioq. 2006;5:93-100.
- Murphy CM, O’Brien FJ, Little DG, Schindeler A. Cell-scaffold interactions in the bone tissue engineering triad. European Cells and Materials. 2013;26:120-132. doi: 10.22203/eCM.v026a09
- Bao X, Zhu L, Huang X, Tang D, He D, Shi J. & Xu G. 3D biomimetic artificial bone scaffolds with dual-cytokines spatiotemporal delivery for large weight-bearing bone defect repair. Nature Scientific Reports. 2017;7:7814. doi:10.1038/s41598-017-08412-0
- Kumar G, Tison CK, Chatterjee K, Pine PS, McDaniel JH, Salit ML, Simon CG. The determination of stem cell fate by 3D scaffold structures through the control of cell shape. Biomaterials. 2011;32(35):9188–9196.
- Liu Y, Lim J,& Teoh S-H. Review: development of clinically relevant scaffolds for vascularised bone tissue engineering. Biotechnology Advances. 2013;31(5):688–705.
- Roseti L, Parisi V, Petretta M, Cavallo C, Desando G, Bartolotti I, Grigolo B. Scaffolds for bone tissue engineering: State of the art and new perspectives. Materials Science and Engineering C. 2017;78:1246–1262
- Morales Navarro D. Ingeniería tisular como puntal de la medicina regenerativa en estomatología. Rev Cubana Estomatol. 2014;51(3):288-304
- Rodríguez Pérez E. Diseño de nuevos biomateriales basados en redes poliméricas interpenetradas de ácido hialurónico y polímeros acrílicos. Tesis Doctoral (2017) Universitat de Valencia. [citado 13-08-2018]. Disponible en: https://riunet.upv.es/bitstream/handle/10251/90632/RODRÍGUEZ – Diseño de nuevos biomateriales basados en redes poliméricas interpenetradas de Ácido ….pdf?sequence=1
- Wu S, Liu X, Yeung KWK. Liu C, Yang X. Biomimetic porous scaffolds for bone tissue engineering. Mater Sci Eng R Rep. 2014;80:1–36.
- Khan F. & Tanaka M. Designing smart biomaterials for tissue engineering. Int. J. Mol. Sci. 2018;19(1):17-30; doi:10.3390/ijms19010017
- Li L, He ZY, Wei XW, Wei YQ. Recent advances of biomaterials in biotherapy. Regen Biomater. 2016;3(2):99-105. doi:10.1093/rb/rbw007.
- Walsh W. R, Vizesi F, Michael D, Auld J, Langdown A, Oliver R, Yu Y, Irie H, Bruce W. β-TCP bone graft substitutes in a bilateral rabbit tibial defect model. Biomaterials. 2008;29(3):266-271. doi:10.1016/j.biomaterials.2007.09.035
- Yuan H, Fernandes H, Habibovic P, de Boer J, Barradas AM, Walsh WR, van Blitterswijk CA, De Bruijn JD. Smart biomaterials and osteoinductivity. Nat. Rev. Rheumatol. 2011;7:c1.
- González Alconada R. Regeneración ósea en un modelo de xenotrasplante de células madre Tesis de doctorado. Universidad de Salamanca, 2015.
- Miron RJ, Zhang Q, Sculean A, Buser D, Pippenger BE, Dard M, Shirakata Y, Chandad F, Zhang Y. Osteoinductive potential of 4 commonly employed bone grafts. Clinical Oral Investigations. 2016;20(8):2259–2265.
- Roldán Vasco S, Vargas Isaza CA, Mejía Suaza ML, Zapata Giraldo J, Moncada Acevedo ME. Ingeniería de tejidos y aplicaciones. Fondo Editorial ITM (2016) p.276-341. ISBN: 978-958-8743-84-4. doi:org/10.22430/9789588743844
- Chen Q, Zhu C, &Thouas GA. Progress and challenges in biomaterials used for bone tissue engineering: bioactive glasses and elastomeric composites. Progress in Biomaterials. 2012;1(1):2-23. doi:org/10.1186/2194-0517-1-2
- Van Bael S, Chai YC, Truscello S, Moesen M, Kerckhofs G, Van Oosterwyck H, Kruth JP, Schrooten J. The effect of pore geometry on the in vitro biological behavior of human periosteum-derived cells seeded on selective laser-melted Ti6Al4V bone scaffolds. Acta Biomater. 2012;8(7):2824–34.
- van Hengel IAJ, Riool M, Fratila-Apachitei LE et al. Selective laser melting porous metallic implants with immobilized silver nanoparticles kill and prevent biofilm formation by methicillin-resistant Staphylococcus aureus. Biomaterials. 2017;140:1–15.
- Lee EJ, Kasper FK, &Mikos AG. Biomaterials for Tissue Engineering. Annals of Biomedical Engineering. 2014;42(2):323–337. doi:10.1007/s10439-013-0859-6
- Mieszawska AJ, Fourligas N, Georgakoudi I, Ouhib N, Belton DJ, Perry CC, & Kaplan DL. Osteoinductive silk-silica composite biomaterials for bone regeneration. Biomaterials. 2010;31(34):8902–8910. doi:10.1016/j.biomaterials.2010.07.109
- Solís Moré Y. Desarrollo de composites basados en quitosana/apatita y quitosana/ apatita silicato como material soporte para regeneración ósea. Tesis de doctorado. Universidad de La Habana. Editorial Universitaria (2015). ISBN 959-16-2714-8.
- Zheng A, Cao L, Liu Y, Wu J, Zeng D, Hu L, Zhang X, Jiang X. Biocompatible silk/calcium silicate/sodium alginate composite scaffolds for bone tissue engineering. Carbohydrate Polymers. 2018;199:244–255. doi:10.1016/j.carbpol.2018.06.093
- Schugens C, Maquet V, Grandfils C, Jerome R, Teyssie P. Polylactide macroporous biodegradable implants for cell transplantation. II. Preparation of polylactide foams by liquid–liquid phase separation. J Biomed Mater Res. 1996;30(4):449–461.
- Liulan L, Qingxi H, Xianxu H, Gaochun X. Design and fabrication of bone tissue engineering scaffolds via rapid prototyping and CAD. Journal of Rare Earths. 2007;25(2):379-383 doi:10.1016/S1002-0721(07)60510-9
- Woźniak P, Bil M, Ryszkowska J, Wychowański P, Wróbel E, Ratajsk, A, Lewandowska-Szumie, M. Candidate bone-tissue-engineered product based on human-bone-derived cells and polyurethane scaffold. Acta Biomaterialia. 2010;6(7):2484–93. doi:10.1016/j.actbio.2009.10.022
- Li Y, Huang W, Cook W. D, Chen Q. A comparative study on poly(xylitol sebacate) and poly(glycerol sebacate): mechanical properties, biodegradation and cytocompatibility. Biomedical Materials. 2013;8(3):035006 (10p) doi:10.1088/1748-6041/8/3/035006
- Ghassemi T, Shahroodi A, Ebrahimzadeh MH, Mousavian A, Movaffagh J, Moradi A. Current concepts in scaffolding for bone tissue engineering. Arch Bone Jt Surg. 2018;6(2):90–99
- Kaigler D, Pagni G, Park CH, Braun TM, Holman LA, Yi E, Tarle SA, Bartel RL, Giannobile WV. Stem cell therapy for craniofacial bone regeneration: a randomized, controlled feasibility trial. Cell Transplant. 2013;22(5):767-777.
- Black CRM, Goriainov V, Gibbs D, Kanczler J, Tare RS, & Oreffo ROC. Bone tissue engineering. Current Molecular Biology Reports. 2015;1(3):132–140. doi:10.1007/s40610-015-0022-2
- Kuroda R, Matsumoto T, Niikura T, Kawakami Y, Fukui T, Lee SY, Mifune Y, Kawamata S, Fukushima M, Asahara T, Kawamoto A, Kurosaka M. Local transplantation of granulocyte colony stimulating factor-mobilized CD34+ cells for patients with femoral and tibial nonunion: pilot clinical trial. Stem Cells Transl Med. 2014; 3(1):128-134.
- Orzechowska-Wylęgała B, Dobrowolski D, Puzzolo D, Wowra B, Niemiec W, Wylęgała A, Szczubiałka K. Use of autologous epithelium transplantation on various scaffolds to cover tissue loss in oral cavity: long-term observation. J Appl Biomater Funct Mater. 2017;15(1):e25-e30. doi:10.5301/jabfm.5000312.
- Noronha Oliveira M, Rau LH, Marodin A, Corrêa M, Corrêa LR, Aragones A, Magini RS. Ridge preservation after maxillary third molar extraction using 30% porosity PLGA/HA/β-TCP scaffolds with and without simvastatin: a pilot randomized controlled clinical trial. Implant Dent. 2017;26(6):832-840. doi:10.1097/ID.0000000000000655.
- Sotome S, Ae K, Okawa A, Ishizuki M, Morioka H, Matsumoto S, Nakamura T, Abe S, Beppu Y, Shinomiya K. Efficacy and safety of porous hydroxyapatite/type 1 collagen composite implantation for bone regeneration: A randomized controlled study. J Orthop Sci. 2016;21(3):373-80. doi:10.1016/j.jos.2016.01.007.
- Henkel J. Woodruff MA, Epari DR, Steck R, Glatt V, Dickinson IC, Choong PFM, Schuetz MA, Hutmacher DW. Bone regeneration based on tissue engineering conceptions — A 21st century perspective. Bone Res. 2013;1(3):216–248.doi:10.4248/BR201303002
- Bose S, Vahabzadeh S, Bandyopadhyay A. Recent advances in bone tissue engineering scaffolds. Materials today. 2013;30(10):546–554. doi:10.1016/j.tibtech.2012.07.005
- Yuan, H, Fernandes H, Habibovic P, de Boer J, Barradas AMC, de Ruiter A, Walsh WR, van Blitterswijk CA, de Bruijn JD. Osteoinductive ceramics as a synthetic alternative to autologous bone grafting. Proceedings of the National Academy of Sciences of the United States of America. 2010;107(31):13614–13619. doi:10.1073/pnas.1003600107
- Kumar G, Waters MS, Farooque TM, Young MF, & Simon CG. Freeform fabricated scaffolds with roughened struts that enhance both stem cell proliferation and differentiation by controlling cell shape. Biomaterials. 2012;33(16),4022–4030. doi:10.1016/j.biomaterials.2012.02.048
- Kucińska-Lipka J, Gubanska I, Pokrywczynska M, Ciesliński H, Filipowicz N, Drewa T, Janik H. Polyurethane porous scaffolds (PPS) for soft tissue regenerative medicine applications. Polymer Bulletin. 2018;75(5):1957–1979.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Alberto Martín Piedra. Centro de Salud Lucano. Calle Lucano, s/n, 14003 Córdoba