Original
Comportamiento de fibroblastos humanos cultivados en las membranas de huevo para su aplicación en ingeniería tisular
Human fibroblast behavior cultured in the eggshell membranes for tissue engineering applications
Actual. Med. 2018; 103: (805). 126-129 DOI: 10.15568/am.2018.805.or02
Enviado: 12-09-2018
Revisado: 22-09-2018
Aceptado: 24-11-2018
ABSTRACT
The eggshell membrane has been long time considered as a waste material. However, recent studies have shown its usefulness for different purposes such as biological applications. In the present work, a study has been carried out to identify the eggshell membrane main components and to determine its feasibility for being used as a biomaterial in tissue engineering. Fibroblasts were cultured in eggshell membrane and then histological and histochemical analysis were performed. Results show not only the presence of collagen and proteoglycans, but also the viability of cells inside the membrane. These results revealed the eggshell membrane potential used as a biomaterial in tissue engineering.
Keywords: Eggshell membrane, tissue engineering, histochemistry; histology.
RESUMEN
La membrana de la cáscara del huevo ha sido considerada durante mucho tiempo como un material de desecho. Sin embargo, estudios recientes han demostrado su utilidad para diferentes propósitos, como las aplicaciones biológicas. En el presente trabajo, se ha realizado un estudio para identificar los componentes principales de la membrana de la cáscara del huevo y para determinar la posibilidad de usarlo como un biomaterial en ingeniería tisular. Para ello, se cultivaron fibroblastos en una membrana de cáscara de huevo y luego se realizaron análisis histológicos e histoquímicos. Los resultados muestran no solo la presencia de colágeno y proteoglicanos, sino también la viabilidad de las células dentro de la membrana. Estos resultados revelan el potencial de la membrana de la cáscara del huevo para ser utilizado como biomaterial en ingeniería tisular.
Palabras clave: Membrana de cáscara de huevo, ingeniería tisular, histoquímica; histología.
Leer Artículo Completo
INTRODUCCIÓN
La cáscara de huevo (CH) y sus membranas se han considerado como un material de desecho sin utilidad aparente, hasta que recientemente se ha descubierto la composición y las propiedades de la misma. Las membranas de la cáscara de huevo (MCH) están formadas por fibras de colágeno altamente entrecruzadas (1), proteoglicanos y glicoproteínas, las cuales se organizan en dos membranas de diferente composición química, las cuales son: una membrana densa (MCH1) externa, y una membrana laxa (MCH2) interna. En cuanto a la composición estructural de la MCH cabe destacar que constituyen una matriz extracelular (MEC) porosa que ofrece una amplia variedad de aplicaciones biomédicas (2). En general, estas membranas, que son completamente acelulares, tienen por ventaja su gran disponibilidad, fácil disposición obtención y baja toxicidad y/o riesgo de transmisión de agentes patógenos. Gracias a estas propiedades las MCH emergen como un posible biomaterial para diversas aplicaciones en el campo de la ingeniería tisular (3).
La MEC es un complejo macromolecular constituido por un conjunto de fibras embebidas en un gel altamente hidratado de polisacáridos (4). La MEC desempeña un rol fundamental en la organización estructural de tejidos y órganos. Además, diversas moléculas de la MEC regulan procesos celulares como proliferación, migración, diferenciación y/o muerte celular (3,5). Es por ello que en ingeniería tisular se utilizan diversos biomateriales para recrear la estructura y composición molecular de la MEC nativa de los tejidos a regenerar o reemplazar (6). Dentro de las moléculas de interés para ingeniería tisular destacan las fibras de colágeno, las fibras elásticas y glicoproteínas como laminina o fibronectina, de las cuales se han logrado generar diversos hidrogeles y biomateriales (7,8). Además, la ingeniería tisular tiene por objetivo la búsqueda de alternativas terapéuticas para la reparación, sustitución o mejora de los tejidos y órganos dañados (6). Es por eso que la MEC derivada de la MCH emerge como un material natural que podría servir de sustrato estructural para la construcción de tejidos y órganos (3).
La comunidad científica ha hecho grandes avances en el estudio de la MCH y sus posibles aplicaciones (9) pero es necesario una caracterización ex vivo del biomaterial con el fin de determinar su potencialidad utilidad como biomaterial en la ingeniería tisular. Por ello, el objetivo del trabajo es evaluar la potencial utilidad de las membranas de huevo como posible biomaterial para aplicaciones en ingeniería tisular. Para ello, se cultivaron fibroblastos de mucosa oral que posteriormente se implantaron en membrana laxa (MCH2) y membrana densa (MCH1) de cáscara de huevo. Transcurrido varios días en cultivo, se procedió al estudio del comportamiento de fibroblastos humanos mediante técnicas histológicas.
MATERIALES Y MÉTODOS
Aislamiento, cultivo y siembra de los fibroblastos humanos
Las células se aislaron y cultivaron tal y como se ha publicado previamente (10). Brevemente, se usó una solución de Colagenasa tipo I de Clostridum hystoliticum al 2% a 37ºC durante 10 a 12 horas para digerir la matriz extracelular de muestras de mucosa oral humana. Las células se recogieron con una centrifugación a 1000 rpm durante 10 minutos. El medio de cultivo fue medio DMEM (Dulbecco’s Modified Eagle Medium) suplementado con 10% de suero bovino fetal (FBS) y un 1% de antibióticos/antimicóticos. Las células se subcultivaron usando una solución de tripsina 0,5g/L y EDTA (Ácido etilendiaminotetraacético) 0,2g/L (Sigma Aldrich). Todas las células usadas en este estudio corresponden a los cinco primeros pases celulares (11). Posteriormente las células se sembraron en membranas de huevo durante 7 días.
Evaluación microscópica de los fibroblastos en las membranas de huevo
Después de este tiempo. las muestras fueron fijadas en formalina al 10% e incluidas en parafina. Posteriormente se hicieron cortes de 5 um que fueron teñidos con las siguientes tinciones histoquímicas: hematoxilina y eosina, picrosirius (12), azúl alcián y orceina. Una vez aplicadas las tinciones los cortes se fotografiaron a 100X, 200X y 400X con un microscopio óptico Nikon Eclipse 90i ((Nikon Corp., Tokyo, Japan)
RESULTADOS
Estudio de los componentes estructurales generales
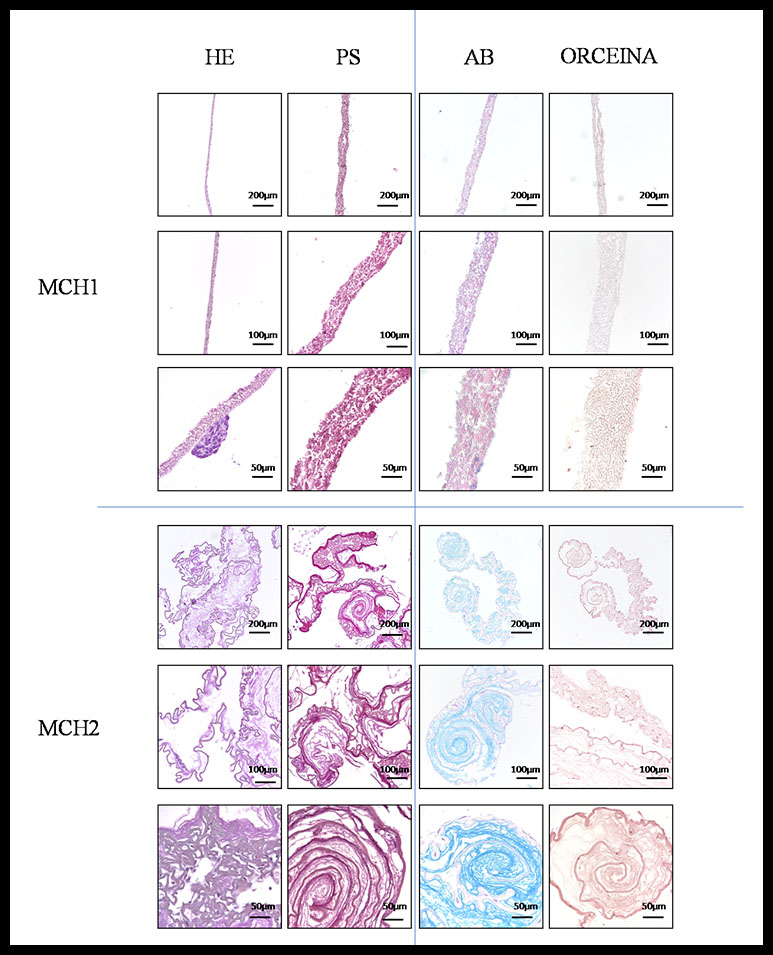
La tinción de Hematoxilina Eosina reveló unas estructuras basófilas unidas a las membranas de manera diferente en la MCH1 y en la MCH2. Se observa una clara diferencia estructural en cuanto a estas dos membranas; la MCH1 presenta una organización simple de manera lineal donde se pueden detectar ciertas fragmentaciones a lo largo de la misma, así como falta de compactación. Sin embargo, la MCH2 presenta una organización estructural más compleja y desordenada debido a un enrollamiento sobre sí misma generando ovillos.
Existe una diferencia entre la distribución celular de la MCH1 y la MCH2, en la MCH1 como muestra la figura 1 las células están unidas entre ellas formando pequeñas aglomeraciones celulares y a su vez unidas a una región de la membrana, confirmando la interacción célula-biomaterial. El análisis de la MCH2 reveló la presencia de estructuras basófilas distribuidas de manera dispersa entre los meandros generados por los ovillos (figura 1).
Figura 1.
Estudio de las fibras de colágeno
La tinción de Picrosirius pone en manifiesto la presencia y distribución del colágeno. La MCH1 presenta una tinción positiva de manera homogénea a lo largo de su estructura lineal y simple. Por otro lado, la tinción de MCH2 es positiva y heterogénea en cuanto intensidad ya que se aprecia una diferencia entre la capa externa con respecto la interna que genera más ovillos como se puede apreciar en la imagen de MCH2.
Estudio de los proteoglicanos
El estudio de la presencia de proteoglicanos se realizó mediante la técnica de Azul Alcian. En la parte más laxa de la membrana (MCH1) hubo positividad que se distribuyó principalmente en la matriz extracelular del tejido conjuntivo subyacente al epitelio, delimitando una estructura en red con espacios en su interior. En cambio, el resultado de la tinción en la parte más densa de la membrana (MCH2) fue negativo.
Estudio de las fibras elásticas
El análisis de la presencia de fibras elásticas se llevó acabó mediante la tinción de Orceína, que resultó negativo en ambos tipos de membrana de cáscara de huevo.
DISCUSIÓN
Como hemos comprobado en los resultados de la tinción con Hematoxilina Eosina, las células son capaces de adherirse a la MCH1 y a la MCH2 lo que afirma que este tejido se puede utilizar como molde para campo de ingeniería tisular guiada (2,13,14).
El resultado positivo de la tinción de Picrosirius muestra la presencia de colágeno tal y como se indicaba en los estudios anteriores (1,9,15) El colágeno se reparte de manera diferente en MCH1 en la que se encuentra distribuido a lo largo de la misma de manera homogénea lo que nos indica que en esta membrana el componente mayoritario es el colágeno. Esto puede explicar el hecho de que la MHC1 sea más gruesa y compacta (13) mientras que en la MCH2 el colágeno se distribuye principalmente en la capa externa mientras la interna es la que forma ovillos y estructuras circulares, conteniendo menos colágeno y siendo entonces más laxa.
Los proteoglicanos son moléculas compuestas por un núcleo de proteína al que se unen diversas cadenas de glicosaminoglicanos (GAG). Con la técnica de Azul Alcián hemos podido comprobar la presencia de estas moléculas en la membrana laxa de huevo, lo cual es un hallazgo consistente con otros estudios (16–18) Autores como Bronsch y Diamantstein relacionan esta molécula de forma lineal con la fuerza de la membrana del huevo (19). Otros como Liu no encontraron correlación entre la cantidad de GAG (1) y la dureza o grosor de la membrana. Algunos autores concuerdan en el rol fundamental favoreciendo la organización de la matriz orgánica, el depósito del mineral y el crecimiento del cristal en la membrana del huevo. (1,20). Por tanto, la presencia de estas moléculas en la membrana de huevo laxa apuntan a su potencial utilidad como biomaterial en ingeniería tisular, especialmente para tejidos como la piel, según se ha señalado en otros estudios (6,21).
No se encontraron fibras elásticas en la membrana de huevo, lo cual es consistente con otros trabajos (17). Aun así, según se ha demostrado, la membrana de huevo tiene propiedades elásticas gracias a la su organización específica del colágeno (22) lo cual la convierten en un biomaterial apropiado para su aplicación el desarrollo de tejidos artificiales que precisen de esta propiedad como la piel.
CONCLUSIÓN
A raíz de su estudio mediante microscopia óptica podemos concluir que las membranas de la cascara de huevo promueven el normal funcionamiento y crecimiento de fibroblastos humanos. Nuestros resultados sugieren que las membranas derivadas del huevo poseen propiedades biológicas que apoyan su potencial utilidad como biomaterial en diversas aplicaciones de la ingeniería tisular. Sin embargo, es necesario realizar estudio para demostrar la utilidad de este biomaterial en la regeneración tisular.
BIBLIOGRAFÍA
- Liu Z, Sun X, Cai C, He W, Zhang F, Linhardt RJ. Characteristics of glycosaminoglycans in chicken eggshells and the influence of disaccharide composition on eggshell properties. Poult Sci. 2016;95(12):2879–88.
- Sah MK, Rath SN. Soluble eggshell membrane: A natural protein to improve the properties of biomaterials used for tissue engineering applications. Mater Sci Eng C [Internet]. 2016 Oct 1 [cited 2018 Sep 21];67:807–21. Available from: https://www.sciencedirect.com/science/article/pii/S0928493116304209?via%3Dihub
- Bruckner P. Suprastructures of extracellular matrices: Paradigms of functions controlled by aggregates rather than molecules. Cell Tissue Res. 2010;339(1):7–18.
- Junqueira & Carneiro. Histología básica. Texto y atlas. 12th ed. Editorial Panamericana; 2015. 537 p.
- Rozario T, DeSimone DW. The extracellular matrix in development and morphogenesis: A dynamic view. Dev Biol [Internet]. 2010 May 1 [cited 2018 Oct 18];341(1):126–40. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19854168
- Padmanabhan SK, Salvatore L, Gervaso F, Catalano M, Taurino A, Sannino A, et al. Synthesis and Characterization of Collagen Scaffolds Reinforced by Eggshell Derived Hydroxyapatite for Tissue Engineering. J Nanosci Nanotechnol [Internet]. 2015;15(1):504–9. Available from: http://openurl.ingenta.com/content/xref?genre=article&issn=1533-4880&volume=15&issue=1&spage=504
- Carriel V, Alaminos M, Garzón I, Campos A, Cornelissen M. Tissue engineering of the peripheral nervous system. Expert Rev Neurother [Internet]. 2014 Mar 10 [cited 2018 Oct 18];14(3):301–18. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24506662
- Tsang KY, Cheung MCH, Chan D, Cheah KSE. The developmental roles of the extracellular matrix: beyond structure to regulation. Cell Tissue Res [Internet]. 2010 Jan 3 [cited 2018 Oct 8];339(1):93–110. Available from: http://link.springer.com/10.1007/s00441-009-0893-8
- Baláž M. Eggshell membrane biomaterial as a platform for applications in materials science. Acta Biomater. 2014;10(9):3827–43.
- Sanchez-Quevedo MC, Alaminos M, Capitan LM, Moreu G, Garzon I, Crespo P V., et al. Histological and histochemical evaluation of human oral mucosa constructs developed by tissue engineering. Histol Histopathol. 2007;22(4–6):631–40.
- Oliveira AC, Rodríguez IÁ, Garzón I, Martín-Piedra MÁ, Alfonso-Rodríguez CA, García JM, et al. An early and late cytotoxicity evaluation of lidocaine on human oral mucosa fibroblasts. Exp Biol Med. 2014;239(1):71–82.
- Carriel VS, Aneiros-Fernandez J, Arias-Santiago S, Garzón IJ, Alaminos M, Campos A. A novel histochemical method for a simultaneous staining of melanin and collagen fibers. J Histochem Cytochem [Internet]. 2011 Mar 12 [cited 2018 Oct 18];59(3):270–7. Available from: http://journals.sagepub.com/doi/10.1369/0022155410398001
- Jia J, Liu G, Guo Z-X, Yu J, Duan Y. Preparation and Characterization of Soluble Eggshell Membrane Protein/PLGA Electrospun Nanofibers for Guided Tissue Regeneration Membrane. J Nanomater [Internet]. 2012 Feb 29 [cited 2018 Oct 8];2012:1–7. Available from: http://www.hindawi.com/journals/jnm/2012/282736/
- Yi F, Guo ZX, Zhang LX, Yu J, Li Q. Soluble eggshell membrane protein: Preparation, characterization and biocompatibility. Biomaterials. 2004;25(19):4591–9.
- Ruff KJ, Winkler A, Jackson RW, DeVore DP, Ritz BW. Eggshell membrane in the treatment of pain and stiffness from osteoarthritis of the knee: A randomized, multicenter, double-blind, placebo-controlled clinical study. Clin Rheumatol. 2009;28(8):907–14.
- Nakano T, Ikawa N, Ozimek L. Extraction of glycosaminoglycanes from chicken eggshell. Poult Sci. 2001;80:681–4.
- Baker JR, Balch D a. A study of the organic material of hen’s-egg shell. Biochem J [Internet]. 1962;82(1956):352–61. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=1243460&tool=pmcentrez&rendertype=abstract
- PANHELEUX M, BAIN M, FERNANDEZ MS, MORALES I, GAUTRON J, ARIAS JL, et al. Organic matrix composition and ultrastructure of eggshell: A comparative study. Br Poult Sci [Internet]. 1999 Apr 28 [cited 2018 Oct 8];40(2):240–52. Available from: http://www.tandfonline.com/doi/abs/10.1080/00071669987665
- Bronsch K, Diamantstein T. Mucopolysaccharides as a localized factor of egg-shell stability [20]. Nature. 1965;207(4997):635–6.
- Carrino DA, Dennis JE, Wub T, Arias JL, Fernandez MS. The Avian Eggshell Extracellular Matrix as a Model for Biomineralization. 1996;3(216):379–82.
- Park S, Choi KS, Lee D, Kim D, Lim KT, Lee KH, et al. Eggshell membrane: Review and impact on engineering. Biosyst Eng [Internet]. 2016;151:446–63. Available from: http://dx.doi.org/10.1016/j.biosystemseng.2016.10.014
- Torres FG, Troncoso OP, Piaggio F, Hijar A. Structure–property relationships of a biopolymer network: The eggshell membrane. Acta Biomater [Internet]. 2010 Sep 1 [cited 2018 Oct 8];6(9):3687–93. Available from: https://www.sciencedirect.com/science/article/pii/S1742706110001406?via%3Dihub
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Víctor Carriel. Dpto. de Histología de la Facultad de Medicina de Granada. Avda. de la Investigación, 11 · 18016 Granada. E-mail: vcarriel@ugr.es