Original
Arterioesclerosis carotídea: correlación clínico-histológica de placas vulnerables
Carotid atherosclerosis: clinical-histological correlation in vulnerable plaques
Actual. Med. 2018; 103: (804): 61-65 DOI: 10.15568/am.2018.804.or01
Enviado: 03-06-2018
Revisado: 26-06-2018
Aceptado: 02-08-2018
RESUMEN
Objetivos: Caracterizar histológicamente placas humanas carotídeas vulnerables para plantear nuevas opciones diagnósticas y terapéuticas mediante la aplicación de nanomateriales en pacientes asintomáticos.
Métodos: Se incluyeron tres pacientes varones, con enfermedad carotidea e indicación quirúrgica (endarterectomía). Las placas fueron teñidas con hematoxilina-eosina, tricrómico de Masson, picrosirius y orceína. Se analizaron histológicamente, determinando su remodelamiento, núcleo lipídico, infiltración inflamatoria, presencia de células espumosas, calcificación y neovascularización con hemorragia. Se realizo un análisis estadístico comparativo del porcentaje de fibrosis, así como de su intensidad por tercios entre las muestras e intramuestra.
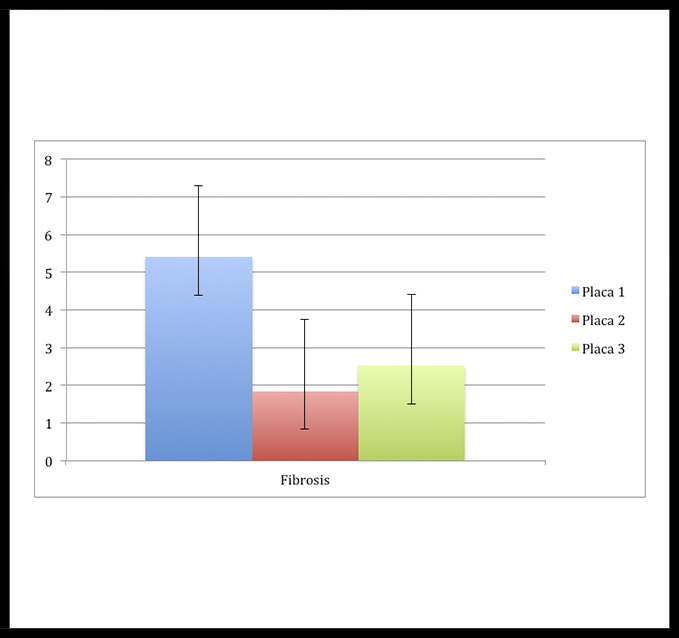
Resultados: A nivel clínico, la placa 1 era sintomática, correspondía a un paciente con antecedente de accidente isquémico transitorio, el paciente 2 presentaba un aneurisma carotideo con gran trombo mural y la placa 3 era asintomática. A nivel histológico, las placas 1 y 2 se asociaban con un estadio más evolucionado que la placa 3. Las placas 1 y 2 presentaron ruptura de su pared, intenso infiltrado de macrófagos, abundante calcificación y neovascularización con hemorragia intraplaca. Las placas carotídeas diferían principalmente en el grado de fibrosis. En concreto, la placa 3 destacó por la presencia de células espumosas migrando hacia el núcleo lipídico y la formación de líneas de calcificación. El estudio estadístico mostró una notable fibrosis de la placa 1 (5,4%), siendo inferior en la placa 3 (2,51%) y en la 2 (1,84%). Así mismo, se observaron diferencias estadísticamente significativas al comparar el tercio inferior de las placas 1 y 3, y en el análisis intramuestra de la placa 2.
Conclusiones: El presente estudio permitió determinar las características histológicas de placas vulnerables que se pueden asociar con la manifestación de síntomas clínicos. Estos hallazgos, sugieren un conocimiento potencial para el desarrollo de nuevas opciones diagnósticas y terapéuticas que mejoren las herramientas actualmente disponibles.
Palabras clave: Arterioesclerosis, estenosis carotidea, placa vulnerable, accidente cerebrovascular, nanopartículas.
ABSTRACT
Objectives: Histological characterization of vulnerable human carotid plaques to propose new diagnostic and therapeutic options through the application of tissue engineering strategies in asymptomatic patients.
Methods: In this study three male patients were included who presented carotid disease with surgical criteria (classic endarterectomy). The plaques were stained with hematoxylin-eosin, Masson’s trichrome, picrosirius and orcein. All samples were histologically analyzed to study remodeling capability, lipid nucleus, inflammatory infiltration, presence of foam cells, calcification, neovascularization and intraplaque hemorrhage. In addition, we performed a comparative statistical analysis of the fibrosis percentage, as well as its intensity by thirds between samples and intra-sample.
Results: Clinical analysis revealed that Plaque 1 was syntomathic, trigging a stroke. Plaque 2 set up a carotid aneurism with a large mural thrombus. Plaque 3 was asynthomatic. Histologycal analysis from Plaques 1 and 2 determined they had developed a more advanced stage than Plaque 3. Plaques 1 and 2 were rupture plaques with a severe macrophages infiltrated and overall calcification and neovascularization with hemorrage. All plaques differed in the degree of fibrosis. At Plaque 3 foams cells were standing out, migrating to lipidic nucleous, as well as calcification lines. Statistic analysis presented a notorious Plaque 1 fibrosis (5,4%), below Plaque 3 (2,51%), and Plaque 2 (1,84%). They were statistically significant differences between the lower third of Plaques 1 and, 3, and at intra-sample analysis of Plaque 2.
Conclusions: The present study allowed us to determine the histological characteristics of vulnerable plaques that can be associated with the manifestation of clinical symptoms. These findings suggest a potential knowledge for the development of new diagnostic and therapeutic options that improve clinical currently available tools.
Keywords: Atherosclerosis, carotid stenosis, vulnerable plaque, stroke, nanoparticles.
Leer Artículo Completo
INTRODUCCIÓN
La enfermedad cerebrovascular isquémica (ECVI) tiene una alta prevalencia en el mundo. Se estima que cada año se producen 1,4 millones de casos, siendo la segunda causa más común de muerte en Europa. Más de la mitad de los pacientes que sobreviven a estos eventos presentan dependencia en las actividades básicas de la vida diaria. Se trata por tanto de un problema de salud relevante, que supone una enorme carga financiera en los sistemas de salud y a los cuidadores (1,2).
La principal causa de ictus isquémico son los fenómenos tromboembólicos. En general, hasta en un 20% de los casos este material embolígeno procede de la ruptura de una placa arterioesclerótica previa a nivel de la arteria carótida interna (ACI) que provoca una estenosis superior al 50% (1).
La ateroesclerosis comienza, desde edades tempranas, con la entrada de partículas de LDL al espacio subintimal, que bajo ciertas condiciones metabólicas llegan a oxidarse. Esto conduce a la señalización y entrada de monocitos que son activados por las moléculas de adhesión de la superficie endotelial iniciándose un proceso de inflamación local, en el que las células musculares lisas también son atraídas a dicha área. Durante este evento, los monocitos se convierten en macrófagos que absorben los lípidos y se transforman en células espumosas. Por otra parte, con la apoptosis de estas células se libera su carga lipídica con un alto contenido de colesterol al espacio extracelular, atrayendo a más macrófagos, formándose así un núcleo lipídico necrótico, que queda confinado entre la membrana elástica externa e interna de la arteria, cubierto por una capa esclerótica fibrosa. La cristalización del colesterol conlleva un aumento de volumen en dicha zona, que provoca la estenosis de la luz arterial, y que produce un adelgazamiento de la capa fibrosa facilitando su ruptura y precipitando la embolización.
Esta evolución del proceso de formación de la placa carotidea está condicionado por los factores de riesgo vascular, destacando el tabaquismo, la dislipemia, la diabetes mellitus y la hipertensión arterial (2-4). En este contexto, se considera una placa sintomática cuando ha producido un evento neurológico (amaurosis transitoria, AIT o ictus “menor”) en los 6 meses previos a su diagnóstico.
El tratamiento de la patología carotidea incluye la terapia médica desde estadios precoces (antiagregantes, estatinas y antihipertensivos), acompañado de intervencionismo (endarterectomía o stent carotideo) cuando existe una estenosis significativa (>50%) sintomática. En los pacientes asintomáticos la indicación quirúrgica se basa en la actualidad únicamente en parámetros hemodinámicos, cuando superan un grado de estenosis >70%. En este sentido, existe una gran controversia al respecto, ya que esta recomendación no incluye otros aspectos relacionados con la vulnerabilidad de la placa, que no solo se asocia al grado de estenosis. Es por ello un desafío elegir el tratamiento óptimo de estos pacientes (1,5,6).
El objetivo del presente estudio fue caracterizar placas carotideas humanas obtenidas mediante cirugía, con el fin de determinar la importancia de diversas características histológicas de las placas vulnerables, que puedan ayudar a plantear nuevas opciones diagnósticas y terapéuticas que integren los avances en ingeniería tisular.
MATERIAL Y MÉTODO
Pacientes incluidos
Se incluyeron tres pacientes (P1, P2 y P3) varones con enfermedad carotidea e indicación de tratamiento quirúrgico. El rango de edades fue 66-79 años. Entre los factores de riesgo vascular, destacaba el antecedente de tabaquismo y dislipemia en todos los casos. Tres de ellos además eran hipertensos y dos presentaban diabetes.
Análisis histológico
Los pacientes a los cuales se tomaron las muestras de placas carotideas fueron intervenidos mediante endarterectomía clásica con cierre con parche biológico, bajo anestesia general. Las placas se extrajeron en bloque y se fijaron en formol tamponado al 4%. Todas las muestras fueron sometidas a un proceso de descalcificación utilizando el método de Ana Morse hasta adquirir una consistencia adecuada para su procesamiento histológico. Una vez descalcificadas las muestras se realizaron secciones transversales de las placas en el origen de la arteria carótida interna. Tras llevar a cabo la deshidratación de estos segmentos se incluyeron en parafina, realizándose cortes de 4-6 µm con micrótomo. Una vez obtenidas las secciones histológicas se realizaron tinciones a las muestras: hematoxilina-eosina, tricrómico de Masson, picrosirius y orceína. En la tinción con hematoxilina-eosina, se observan los núcleos celulares en tono azul teñidos por la hematoxilina, mientras que la eosina tiñe las estructuras eosinofílicas en tonos rojos (7,8). En el caso del tricrómico de Masson se empleó hematoxilina Weigert, preparación de fucsina-escarlata y solución verde ligero. Esta tinción permite identificar el tejido conectivo (colágeno) teñido de verde intenso y la calcificación en tonos violáceos (7). La tinción de Picrosirius se realizó con rojo sirio y solución acuosa saturada de ácido pícrico, mediante esta tinción se evaluó el colágeno presente en la capa fibrosa con una coloración roja rosada. Mediante el uso de luz polarizada se determinó la capa fibrosa, gracias a la birrefrigencia del colágeno. La tinción de orceína se realizó mediante el uso de solución de orceína al 1% en alcohol absoluto y picrocarmin de Índigo. Esta tinción detecta la presencia de fibras elásticas en la arteria. El estudio histológico mediante microscopía óptica tenía como objetivo determinar las siguientes características histológicas:
- Tipo de remodelamiento. El desarrollo de la placa conlleva un remodelado de la pared arterial. La placa puede crecer hacia la luz del vaso produciendo una mayor estenosis (constrictivo) o hacia fuera, produciendo un aumento del diámetro de la arteria (expansivo) (9).
- Núcleo lipídico. Se caracteriza por la presencia de material amorfo con abundantes cristales de colesterol.
- Infiltrado inflamatorio de macrófagos y linfocitos. Estas células están implicadas en el desarrollo de la placa, así como la presencia de células espumosas.
- Calcificación de la placa. Se puede presentar como núcleos de calcificación o de forma concéntrica en la periferia del núcleo lipídico.
- Vascularización, hemorragia intraplaca. Se identifica neovascularización, que puede acompañarse de hemorragia intraplaca, observándose extravasación de hematíes (7-10).
Análisis estadístico
El análisis estadístico fue realizado en las muestras de placas carotideas teñidas mediante picrosirius con el objetivo de realizar un estudio cuantitativo del grado de fibrosis presente en las muestras. Para llevar a cabo el análisis se calculó el área de fibrosis expresada de forma porcentual y se analizó la intensidad de la fibrosis en cada muestra. Para esto, se dividió el área de la muestra en tercio superior (TS), medio (TM) e inferior (TI). En cada tercio se seleccionaron píxeles, hasta completar 300-400 píxeles por tercio, utilizando la herramienta de procesamiento de imagen digital (Image J©) que permitió calcular las estadísticas de valor de cada píxel seleccionado en relación con su intensidad. Los datos obtenidos fueron evaluados mediante un análisis intermuestras valorando diferencias topográficas estadísticamente significativas en el grado de fibrosis entre las distintas placas. Para ello se aplicó la pruebas U de Mann-Whitney y Kruskal-Wallis. Además, se realizó un análisis intramuestra, para determinar si existían diferencias en el grado de fibrosis dentro de cada muestra, aplicando la prueba de los rangos con signo de Wilcoxon y el test de Friedman.
RESULTADOS
Análisis clínico de los pacientes
Los pacientes fueron clasificados en relación con la clínica que presentaban.
La placa 1 (P1) correspondía a un paciente de 71 años con una estenosis significativa que había producido síntomas neurológicos recientes (pérdida de fuerza en miembro superior derecho y facial derecho). La placa 2 (P2) fue extraída de un paciente de 79 años que presentaba una dilatación aneurismática de la carótida interna con trombosis mural. La placa 3 (P3) procedía de un paciente de 68 años con una estenosis severa (>70%) asintomática.
Análisis histológico
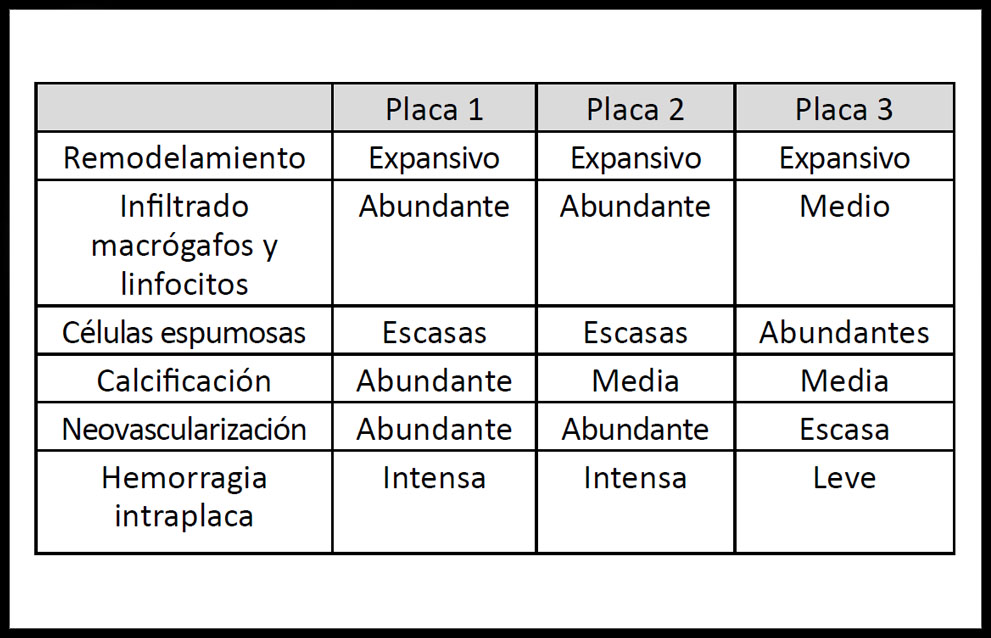
El estudio histológico permitió identificar las principales características histológicas de cada placa (Tabla 1).
Tabla 1. Características histológicas de las placas.
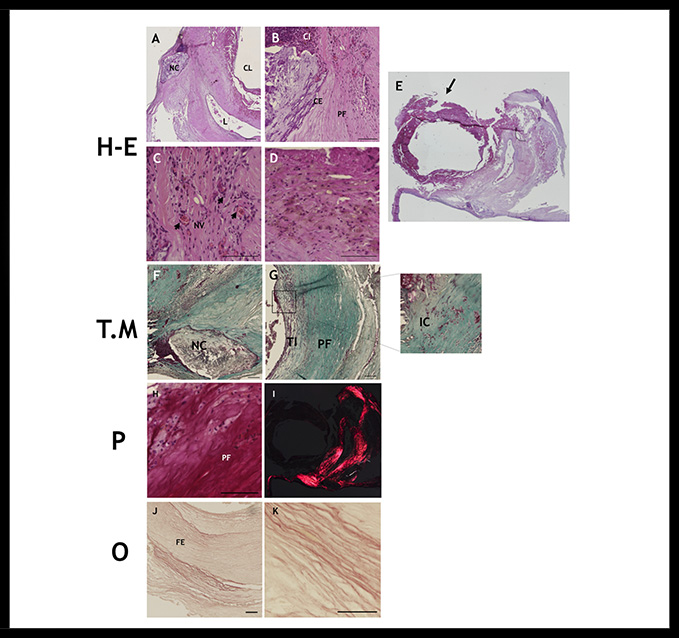
En concreto, el análisis histológico de la placa arterioesclerótica 1 reveló un crecimiento expansivo, existiendo una zona de ruptura de la placa. Se observó la presencia de calcificación, distribuida concéntricamente de forma densa rodeando el núcleo lipídico y en nódulos de calcificación. La placa 1 presentó alto contenido fibrótico al analizarla con luz polarizada, además de intensa vascularización asociada a fenómenos de hemorragia intraplaca (Figura 1).
Figura 1: Análisis histológico placa 1 mediante el uso de técnicas histológicas Hematoxilina-Eosina (H-E), Tricrómico de Masson (T.M), Picrosirius (P) y Orceína (O). A centro lipídico (CL), núcleo de calcificación (NC) y la luz de un vaso intraplaca (L). B infiltrado celular (CI), células espumosas (CE), proceso fibrótico (PF). C neovascularización (NV) con hemorragia (flechas cortas). D extravasación de hematíes. E imagen global, zona de ruptura (flecha). F núcleo de calcificación (NC). G túnica íntima (TI), proceso fibrótico (PF), amplificación del infiltrado celular. H proceso fibrótico. I Luz polarizada: intensa fibrosis. J, K fibras elásticas (FE). Barra de magnificación 100µm.
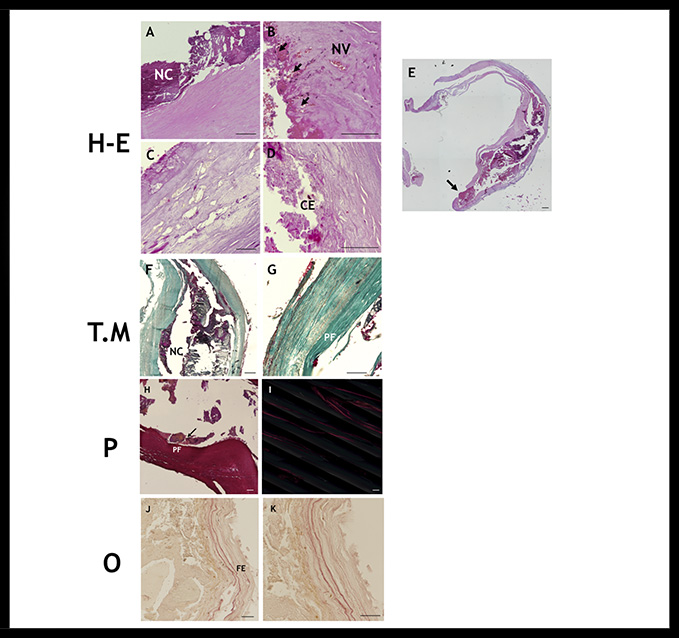
Por otra parte, los resultados de la placa 2 mostraron un remodelamiento expansivo de la pared arterial, con ruptura de la placa. Infiltración abundante de linfocitos y macrófagos desde la túnica íntima con escasas células espumosas. Abundante vascularización con intensa hemorragia intraplaca y disposición de la calcificación concéntrica al núcleo lipídico, con severo adelgazamiento de la capa fibrótica (Figura 2).
Figura 2: Análisis histológico placa 2 mediante el uso de técnicas histológicas Hematoxilina-Eosina (H-E), Tricrómico de Masson (T.M), Picrosirius (P) y Orceína (O). A calcificación (NC). B neovascularización (NV), hemorragia (flechas cortas). C infiltrado celular. D células espumosas (CE). E imagen global, zona de ruptura (flecha). F calcificación (NC). G, H proceso fibrótico (PF). I luz polarizada: escasa fibrosis. J, K fibras elásticas (FE). Barra de magnificación 100 µm.
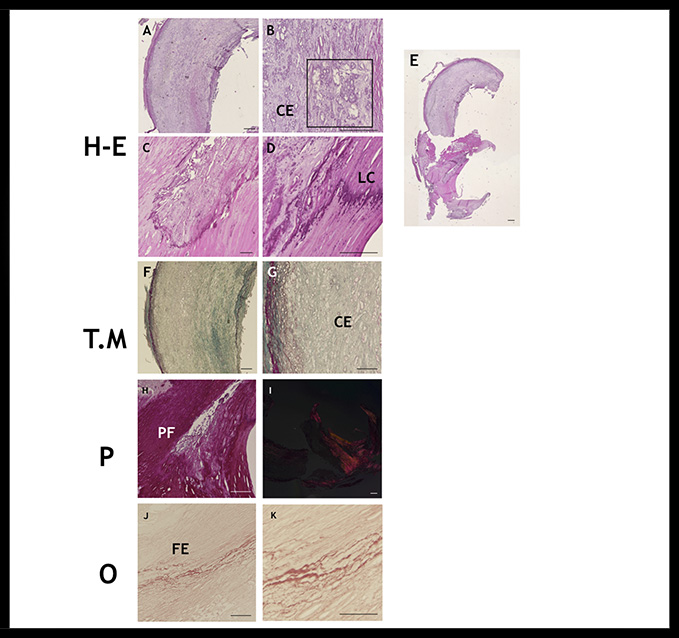
La placa 3 presentaba un crecimiento expansivo, sin zona de ruptura. En este sentido, destaca la infiltración de linfocitos y macrófagos, así como la migración de células musculares lisas hacia el espacio subendotelial, presentando engrosamiento del mismo con abundantes células espumosas. Las células espumosas se disponían hacia el núcleo lipídico, en el cual se apreciaba un proceso de calcificación en desarrollo, observándose gránulos que se consolidaban formando líneas de calcificación (Figura 3).
Figura 3: Analísis histológico placa 3 mediante el uso de técnicas histológicas Hematoxilina-Eosina (H-E), Tricrómico de Masson (T.M), Picrosirius (P) y Orceína (O). A infiltración celular. B células espumosas (CE). C, D líneas de calcificación (LC). E imagen global. F degradación de la matriz. G células espumosas (CE). H proceso fibrótico (PF). I Luz polarizada: fibrosis media. J, K fibras elásticas (FE). Barra de magnificación 100µm.
Análisis estadístico
El análisis cuantitativo reveló que el área de fibrosis en la placa 1 fue (5,4%), menor en la placa 3 (2,51%) y muy escaso en la placa 2 (1,84%) (Figura 4).
Figura 4: Porcentaje del área de fibrosis para las muestras de placa carotidea (P1, P2, P3), mediante la cuantificación de la tinción de Picrosirius.
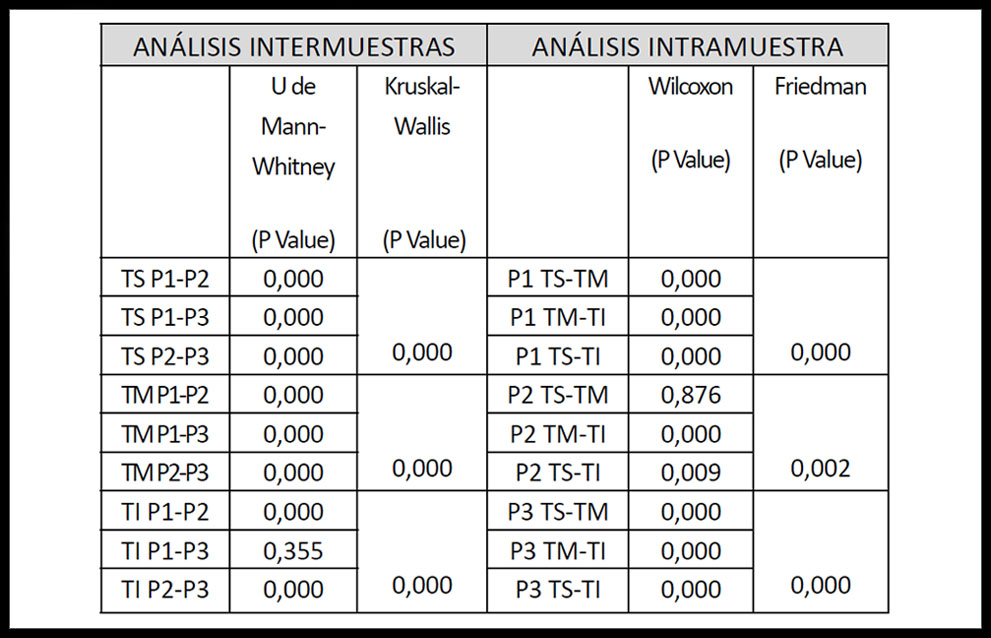
Al realizar el análisis intermuestras no se encontraron diferencias significativas en las comparaciones de las placas a nivel del tercio superior y del tercio medio (P<0,001). Respecto al tercio inferior no existieron diferencias en la comparación de P1 con P2 y P2 con P3, pero si se observó una diferencia estadísticamente significativa en cuanto al grado de intensidad en la comparación entre P1 y P3 (U de Mann Withney P=0,355).
El estudio intramuestra no mostró diferencias significativas al comparar entre si los tres tercios definidos previamente en P1 y P3 (P<0,001). En cambio si presento diferencias significativas en P2, en la comparación individual entre el tercio superior y el medio (prueba de rangos con signo de Wilcoxon P=0,876), así como entre el tercio superior y el inferior (prueba de rangos con signo de Wilcoxon P=0,009). Estas diferencias significativas se mantuvieron presentes al analizar de forma conjunta los tres tercios (Test Friedman P=0,002) (Tabla 2).
Tabla 2. Analísis estadístico: intermuestras e intramuestra.
DISCUSIÓN
La importancia clínica del proceso arterioesclerótico radica en la transformación de una placa estable a inestable. Este concepto de vulnerabilidad de la placa se ha planteado desde hace aproximadamente 20 años, pero ha sido en los últimos años cuando se le ha prestado mayor atención (11).
La arterioesclerosis es un fenómeno evolutivo, que comienza con el engrosamiento fibroso de la íntima, asociado a la formación del núcleo lipídico. La calcificación distrófica y la neovascularización acompañan el proceso. Las manifestaciones clínicas se producen cuando hay una ruptura en la placa y su contenido queda expuesto a la luz, siendo altamente trombogénico y provocando embolismos (10,12,13).
En el presente estudio se ha llevado a cabo una caracterización histológica con el objetivo de correlacionar las características de las tres placas estudiadas con su vulnerabilidad y capacidad para producir sintomatológía clínica. En este sentido, la única placa que llego a producir síntomas neurológicos fue la placa 1. En la placa 2 el proceso arterioesclerótico degenero la pared formando un aneurisma de 1,3 cm que presentaba un gran trombo irregular en superficie. Por otra parte, la placa 3 se intervino de acuerdo al grado de estenosis. Estas diferencias clínicas se relacionaban con los resultados del análisis histológico y estadístico.
Las características histológicas observadas en la placa 1 sugieren un estadio evolutivo avanzado. La placa 1 presentaba abundantes fibras de colágeno en relación con el elevado porcentaje de fibrosis calculado en el análisis estadístico (5,4%). Esta zona de fibrosis predominaba en la túnica media, mientras que prácticamente había desaparecido en la zona de la íntima donde se encontraba el núcleo lipídico observándose zonas de ruptura en la placa. La vascularización era intensa con múltiples focos de hemorragia. En este contexto, las placas que presentan histológicamente una cubierta delgada poco fibrótica se consideran placas vulnerables, por su alto riesgo de ruptura (8,13). Algunos estudios se han centrado en determinar el grosor de esta capa como factor determinante en la producción de síntomas. En el caso de la placa 2, no había producido síntomas aún pero tenía características que se relacionan con una placa evolucionada, presentando similitudes histológicas con respecto a la placa 1. En el análisis estadístico no se encontraron diferencias significativas en cuanto a la intensidad de la fibrosis al compararla con otras muestras, pero sí destacaba un porcentaje de fibrosis menor (1,84%). La capa fibrótica había sufrido un adelgazamiento severo, observándose diferencias intramuestra al analizar la intensidad de la fibrosis en cada tercio. Este fenómeno podría guardar relación con la dilatación aneurismática de la pared arterial. La dilatación de la pared arterial conlleva un adelgazamiento de la íntima, con pérdida de células musculares lisas y fibras elásticas, que se sustituyen progresivamente por tejido inelástico. Este adelgazamiento de la íntima podría haber desencadenado la ruptura de la placa que se observa a nivel histológico, provocando una exposición del contenido del núcleo lípido a la luz arterial que pudo motivar la formación de el gran trombo de superficie que presentaba la placa en las pruebas de imagen realizadas para su diagnóstico.
En el análisis de la placa 3, se identifica un proceso arterioesclerótico menos evolucionado. Destaca una desestructuración de la matriz que se está degradando por la infiltración celular inflamatoria, observándose una migración celular hacia el núcleo lipídico con abundantes células espumosas. Es prominente un proceso de calcificación activo que se presenta de forma granular produciéndose una condensación en forma de líneas de calcificación. Estas diferencias histológicas se acompañan de diferencias significativas en el análisis estadístico intermuestras, en la comparación de la intensidad de la fibrosis entre la placa 1 y la 3, concretamente a nivel del tercio inferior. Este hallazgo podría estar relacionado con la evolución de la placa, y correlacionarse con las diferencias clínicas existentes entre ellas, si bien sería necesario analizar un mayor número de muestras para definirlo.
Los hallazgos del presente trabajo podrían sugerir la importancia de la correlación clínica e histológica para el desarrollo de nuevas herramientas terapéuticas y de diagnóstico. En este sentido, en los últimos años ha llamado la atención el uso experimental de nanopartículas de oro como medio de contraste para detectar el contenido de macrófagos de la pared arterial al ser absorbidas por estas células, permitiendo obtener excelentes imágenes por medio de tomografía computarizada o resonancia magnética (14,15). Por otra parte, el contenido elevado de macrófagos es uno de los principales factores asociados a vulnerabilidad, motivo por el cual los macrófagos vez se han convertido en un prometedor objetivo terapéutico de esta enfermedad . En este contexto, el estudio histológico detallado de placas carotideas humanas podría proveer un avance en la Cirugía vascular.
CONCLUSIONES
Este trabajo es un estudio preliminar encaminado a analizar aquellas características histológicas de las placas carotideas vulnerables que se asocian a la producción de síntomas y que puedan ser diana para el desarrollo de nuevos medios diagnósticos en el seguimiento y tratamiento de los pacientes asintomáticos.
A pesar del reducido tamaño muestral, se pudo comparar tres placas con una evolución diferente, encontrando una correlación clínica con el grado de fibrosis, intensidad de la misma, presencia de macrófagos y de células espumosas, desarrollo de neovascularización y de hemorragia intraplaca. Estos resultados realzan la necesidad de establecer criterios quirúrgicos que no se basen únicamente en parámetros hemodinámicos, y son un aliciente para el uso de nanomateriales que puedan mejorar las pruebas diagnósticas e incluso las opciones terapéuticas de estas enfermedades tan prevalentes.
REFERENCIAS BIBLIOGRÁFICAS
- Naylor AR, Ricco JB, De Borst GJ, et al. Management of atherosclerotic aarotid and verterbral artery disease: 2017 Clinical practice guidelines of the European Society for Vascular Surgery (ESVS). Eur J Vasc Endovasc Surg 2018;55: 3-81.
- Moreno VP, García-Raso A, García-Bueno MJ, et al. Factores de riesgo vascular en pacientes con ictus isquémico. Distribución según edad, sexo y subtipo de ictus. Rev Neurol 2008;46:593-598.
- Tsivgoulis G, Safouris A, Kim DE, Alexandrov AV. Recent advances in primary and secondary prevention of atherosclerotic stroke. Journal of Stroke 2018;20(2):145-166.
- Mughal MM, Khan MK, DeMarco JK, Majid A, Shamoun F, Abela GS. Symptomatic and asymptomatic carotid artery plaque. Expert Rev Cardiovasc Ther 2011;9(10):1315-1330.
- Xia Z, Yang H, Yuan X, et al. High-resolution magnetic resonance imaging of carotid atherosclerotic plaques-a correlation study with histopathology. Vasa 2017;46(4):283-290.
- Howard DP, Van Lammeren GW, Rothwell PM, et al. Symptomatic carotid atherosclerotic disease: correlations between plaque composition and ipsilateral stroke risk. Stroke 2015;46(1):182-189.
- Butcovan D, Mocanu V, Baran D, Ciurescu D, Tinica G. Assessment of vulnerable and unstable carotid atherosclerotic plaques on endarterectomy specimens. Exp Ther Med 2016:11(5): 2028-2032.
- Redgrave Jn, Gallagher P, Lovett JK, Rothwell PM. Critical cap thickness and ruptura in symptomatic carotid plaques. Stroke 2008;39:1722-1729.
- Fepreva.org [internet]. Buenos Aíres: Fepreva; 2012. [citado 30 jul 2018]. Disponible en: http://www.fepreva.org/curso/6to_curso/material/ut20.pdf
- Gallagher PJ, Van der Wal AC. Blood vessels. En: Mills SE, editor. Histology for pathologists. 4th ed. Philadelphia: Lippincott Williams & Wilkins; 2012. p 233-258.
- Teng Z, Sadat U, Brown AJ, Gillard JH. Plaque hemorrhage in carotid artery disease: Pathogenesis, clinical and biomechanical considerations. Journal of Biomechanics 104;47:847-858.
- Konishi T, Funayama N, Yamamoto T, et al. Pathological quantification of carotid artery plaque instability in patients undergoing carotid endarterectomy. Cir J 2018;82:258-266.
- S. Shindo K, Fujii M, Shirakawa K, et al. Morphologic features of carotid plaque ruptura assessed by optical coherence tomography. Am J Neuroradiol 2015;36:2140-2146.
- De Wilde D, Trachet B, Van der Donckt C, et al. Vulnerable plaque detection and quantification with gold particle-enhaced computed tomography in atherosclerotic mouse models. Mol Imaging 2015;14.
- Qin J, Peng C, Zhao B, et al. Nonivasive detection of macrophages in atherosclerotic lesions by computed tomography enhanced with PEGylated gold nanoparticles.Int J Nanomedicine 2014;9:5575-5590.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: María Luisa Robles Martín, Servicio de Angiología y Cirugía Vascular. Hospital Quirónsalud Málaga. Avda. Imperio Argentina 1, 29004 Málaga, España. Correo electrónico: mluisa.robles@quironsalud.es. Teléfono: 952175030