Original
Detección de carbapenemasas en pseudomonas aeruginosa mediante espectometría de masas MALDI-TOF MS
Carbapenemase detection in Pseudomonas aeruginosa by MALDI-TOF MS mass spectrometry
Actual. Med. 2015; 100: (794): 15-17 DOI: 10.15568/am.2015.794.or03
Enviado: 30-06-2014
Revisado: 20-01-2015
Aceptado: 26-01-2015
RESUMEN
Introducción: Las bacterias gramnegativas, especialmente Pseudomonas, presentan con frecuencia resistencia a múltiples antibióticos incluyendo carbapenemes. La resistencia a carbapanemes se ha incrementado en los últimos años causada por alteraciones de membrana o por la producción de carbapenemasas. Objetivo: Valorar la utilización de la espectrometría de masas MALDI-TOF MS® para la detección de carbapenemasas clase A o B en Pseudomonas aeruginosa. Material y métodos: Partiendo de 12 aislados de Pseudomonas aeruginosa productoras de carbapenemasas clase A o B identificados mediante método de difusión disco-placa, tipificadas usando los discos: meropenem 10µg, meropenem 10µg + ácido borónico, meropenem 10µg + cloxacilina y meropenem 10µg + ácido dipicolínico (Rosco Diagnostica), hemos analizado posibles picos de hidrólisis del meropenem tras la acción de las carbapenemasas mediante espectrometría de masas MALDI-TOF MS®. Como controles negativos se utilizaron 25 cepas de Pseudomonas aeruginosa sensibles a meropenem y 8 cepas de Pseudomonas aeruginosa con impermeabilidad de membrana, no detectables mediante la metodología utilizada. Resultados: De las 12 cepas productoras de carbapenemasas clase A o B, (2/12 clase A, 10/12 clase B), la técnica de espectrometría de masas MALDI-TOF MS® detectó picos de degradación del antibiótico en estudio correspondientes a la presencia de carbapenemasas en 11/12 casos (94.4%). En las cepas usadas como controles negativos, la espectrometría de masas MALDI-TOF MS® indicó la ausencia de carbapenemasas clase A o B en 31/33 (93.9%) casos. Conclusión: La espectrometría de masas MALDI-TOF MS® puede ser una herramienta útil para la confirmación de carbapenemasas clase A y B en Pseudomonas aeruginosa.
Palabras clave: Carbapenemasas, MALDI-TOF MS®, Pseudomonas aeruginosa, Detección rápida.
ABSTRACT
Introduction: Gram-negative bacteria especially Pseudomonas are resistance to multiple antibiotics including carbapenems. Carbapanemes resistance has increased in recent years caused by alterations of membrane or the production of carbapenemases.
Objective: Assess the use of MALDI-TOF MS® mass spectrometry for the detection of carbapenemases class A or B in Pseudomonas aeruginosa.
Material and methods: From isolated from Pseudomonas aeruginosa producing carbapenemases 12 class A or B identified by diffusion method disco-plate, classified using disks: meropenem 10μg, meropenem 10μg + boronic acid, meropenem 10μg + cloxacillin and meropenem 10μg + acid dipicolinic (Rosco Diagnostica), we analyzed possible hydrolysis of meropenem peaks after the action of the carbapenemases by MALDI-TOF MS® mass spectrometry. As negative controls were used 25 strains of Pseudomonas aeruginosa sensitive to meropenem and 8 strains of Pseudomonas aeruginosa with waterproof membrane, not detectable by the methodology used.
Results: Of the 12 strains producing carbapenemases class A or B, (2/12 class A, 10/12 class B), MALDI-TOF MS® mass spectrometry technique detected peaks of degradation of the antibiotic in study to the presence of carbapenemases in 11/12 cases (94.4%). The strains used as controls negative, MALDI-TOF MS® mass spectrometry indicated the absence of carbapenemases class A or B at 31/33 cases (93.9%).
Conclusion: MALDI-TOF MS® mass spectrometry can be a useful tool for the confirmation of carbapenemases class A and B in Pseudomonas aeruginosa.
Keywords: Carbapenemases, MALDI-TOF MS®, Pseudomonas aeruginosa, Fast Detection
Leer Artículo Completo
INTRODUCCIÓN
Pseudomonas aeruginosa presenta con frecuencia resistencia a múltiples antibióticos incluyendo carbapenemes, así como una elevada capacidad para adquirir nuevas formas de resistencia, bien por mutaciones o mediante la adquisición de nuevos genes (1-2). La resistencia a carbapanemes se ha incrementado en los últimos años causada por diferentes mecanismos, los más frecuentes son la sobreexpresión de bombas de expulsión y el cierre de porinas OprD (3), aunque no son los únicos ya que en la actualidad la aparición de enzimas que pueden hidrolizar carbapenemes está cobrando cada vez más importancia.
Las carbapenemasas son enzimas que hidrolizan el grupo amida del anillo betalactámico. Según la clasificación de Ambler se pueden estructurar en tres grupos: clase A (grupo 2f de Bush-Jacoby-Medeiros, dependientes de serina e inhibidas parcialmente por el ácido clavulánico, inducibles, no trasferibles; clase B (grupo 3 de Bush-Jacoby-Medeiros), dependientes de zinc, inhibidas por EDTA, inducibles o asociadas a plásmidos conjugativos; y clase C, oxacilinasas.
La espectrometría de masas MALDI-TOF MS ha sido introducida en la rutina de trabajo de los laboratorios de microbiología para la identificación de bacterias y hongos, y puede constituir una herramienta útil en complejos procesos diagnósticos (4). La detección de carbapenemasas por MALDI-TOF MS es un método directo de identificación no estandarizado en la rutina de los laboratorios, que está basado en el análisis espectrofotométrico de la degradación del meropenem por una cepa productora de carbapenemasa (5-6). Los datos que avalan su utilización para el diagnóstico rápido de carbapanemasas en aislados clínicos, o a partir de frascos de hemocultivo positivos en los que se identifica Ps. aeruginosa mediante MALDI-TOF MS son muy escasos.
MATERIAL Y MÉTODOS
Hemos utilizado cultivos en placa (agar sangre Columbia 5%) de 45 aislados clínicos de Ps. aeruginosa con diferente sensibilidad a carbapenemes, 25 sensibles a meropenem y 20 resistentes (clasificados fenotípicamente mediante sistemas automatizados Wider, Vitek). Dentro del grupo de cepas resistentes a carbapenemes hemos empleado 18 cepas productoras de carbapenemasa A y/o B; y 8 cepas con impermeabilidad de membrana, determinado dichos mecanismos de resistencia mediante método de difusión disco-placa, utilizando meropenem 10µg, meropenem 10µg + ácido borónico, meropenem 10µg + cloxacilina y meropenem 10µg + ácido dipicolínico (Rosco Diagnostica), combinaciones cuya interpretación permite establecer si la cepa es productora de carbapenemasa clase A o si es productora de carbapenemasa clase B (7).
Para determinar la presencia de carbapenemasa mediante el análisis por espectrometría de masas MALDI-TOF MS (Bruker Daltonics GmbH, Bremen, Germany) se utilizó cultivo de Ps. aeruginosa y se incubó a 37ºC durante 3 horas y media junto a 10µl de meropenem (AztraZeneca, 10 mg/ml H2O HPLC) en tubos eppendorff estériles. Tas centrifugar el eppendorf durante 2 minutos a 16000rpm, se depositó 1µl del sobrenadante en la placa del espectrómetro de masas MALDI-TOF MS añadiendo tras secado 1µl de matriz HCCA (Ácido -cyano-4-hidroxicinámico). Los espectros se obtuvieron en el rango de masas de 100-1000 Da usando una intensidad de láser 25-35%, cada espectro era la suma de 240 disparos por láser.
Los espectros adquiridos por MALDI-TOF MS se analizaron mediante el software Flexanalysis 3.3 (Bruker Daltonics GmbH, Bremen, Germany) usando el protocolo descrito por Sparbier et al (8). En primer lugar el espectro es suavizado (algoritmo SavitzkyGolay, amplitud 0.2 m/z, ciclo) y posteriormente el espectro se ha adaptado a la línea base (algoritmo, TopHat). Los picos son automáticamente seleccionados con el ajuste de los siguientes parámetros: algoritmo de detección de picos: centrado; máxima señal de detección :2; mínimo umbral de detección 0% ; umbral de intensidad relativa 0%; altura 80%; y son comparados con la masa molecular del meropenem junto a un átomo de hidrógeno [M+H] (384.5 Da) y en forma de sales [M+Na] (406.5 Da), [M+2Na] (428.5 Da) con una tolerancia de 0.5 m/z.
Todos los ensayos se calibraron de a cuerdo a lo descrito por Sparbier et al (8). La calibración se realizo previa a la determinación de los espectros. Para ello se utilizó un calibrador externo suministrado por Bruker Daltonics (GmbH, Bremen, Germany), ajustando los valores de cuatro compuestos bien identificados a su respectivo valor m/z conocido. Dos de estos picos corresponden a la matriz HCCA (alto 379.09 m/z y bajo 190.44 m/z) y otros dos a la bradiquinina 1-5 (572.76 m/z) y a la bradiquinina 1-7 (756.85 m/z).
RESULTADOS
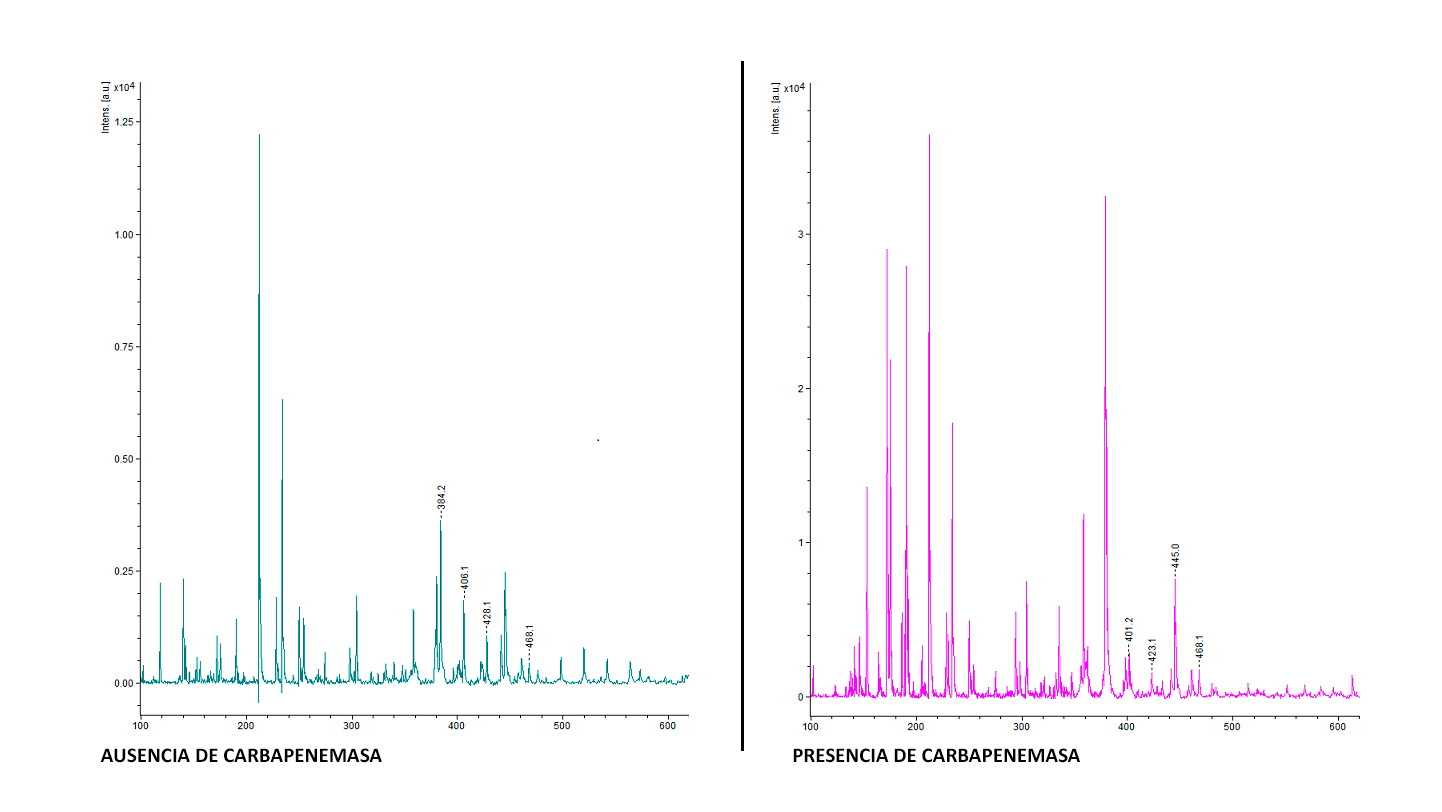
Si la cepa de Ps. aeruginosa es productora de carbapenemasa se produce la hidrólisis del anillo betalactámico del meropenem, modificándose así el pico correspondiente a la masa molecular original del meropenem (+ 18 Da). Tanto la molécula de meropenem original (383.5 Da) como su forma hidrolizada (401.5 Da), meropenem resistente por presencia de carbapenemasa, pueden detectarse en distintas formas de ionización por el espectrómetro de masas. En ausencia de carbapenemasa los picos detectados son los correspondientes a la masa molecular del meropenem junto a un átomo de hidrógeno (H): 384.5 Da [M+H], la adición de 1átomo de sodio (Na): 406.5 Da [M+Na] y 2 átomos de sodio (2Na): 428.5 Da [M+2Na]. En el caso de la hidrólisis del meropenem por la presencia de carbapenemasa se obtiene el pico 401.1 Da junto a sales de sodio, que corresponderían a los picos 423.2 Da (Na), 445.0 Da (2 Na) y 468.1 Da (3 Na). (Figura 1)
Figura 1. Espectro lectura MALDI-TOF MS
De las 12 cepas productoras de carbapenemasas clase A o B, (2/12 clase A, 10/12 clase B) la técnica de espectrometría de masas MALDI-TOF MS detectó picos de degradación del antibiótico en estudio correspondientes a la presencia de carbapenemasas en 11/12 casos (94.4%). Tan solo una cepa clasificada por la técnica de difusión disco-placa como productora de carbapenemasa clase A no fue detectada por la técnica de espectrometría de masas MALDI-TOF. Esta cepa fue clasificada como productora de carbapenemasa clase B mediante técnicas moleculares de PCR.
En las cepas usadas como controles negativos, la espectrometría de masas MALDI-TOF indicó la ausencia de carbapenemasas clase A o B en 31/33 (93.9%) casos En un caso se encontraron picos de degradación por MALDI-TOF MS® y en el otro caso se obtuvo un espectro con mezcla de picos del meropenem intacto e hidrolizado. Mediante técnicas moleculares de PCR estas cepas se clasificaron respectivamente como cepa no productora de carbapenemasa y cepa productora de carbapenemasa clase B (IMP).
Las cepas productoras de carbapenemasa A o B utilizadas (2/12 clase A y 10/12 clase B) fueron testadas mediante técnicas moleculares de PCR encontrándose 2 cepas tipo GES (clase A), 6 cepas tipo VIM y 4 cepas tipo IMP (10 cepas clase B).
Estos datos indican una sensibilidad de la técnica del 94.4%, con una especificidad del 93.9%, un valor predictivo positivo del 96.9% y un valor predictivo negativo del 89.5%.
DISCUSIÓN
La espectrometría de masas MALDI-TOF se acepta en la actualidad como método de rutina para el diagnóstico microbiológico a partir de muestra directa, y ya existen algunas aplicaciones muy prometedoras para su utilización a partir de frascos de hemocultivo (9). Una de sus grandes ventajas es la velocidad con la que se obtiene la identificación, lo que permite un mejor abordaje para el tratamiento empírico de las infecciones que son más difíciles de tratar y con tendencia a ser resistentes. La aplicación de esta tecnología para la identificación de mecanismos de resistencia, de una manera fácil, rápida y certera, podrá sin duda contribuir a transformar el tratamiento empírico en un tratamiento dirigido que garantice el éxito terapéutico.
En nuestro estudio, la utilización de MALDI-TOF MS para detectar la presencia carbapenemasas en cepas de Ps. aeruginosa ha resultado en un elevado valor predictivo positivo (97%) para la detección de carbapenemasas de tipo A y/o B. Nuestros resultados se orientan en la misma dirección que los obtenidos por Jaroslav Hrabák et al. (Journal Clinical of Microbiology, Sept. 2011) donde analizando diferentes enterobacterias (n=124, 53 cepas de Ps. Aeruginosa) con distinta susceptibilidad a meropenem, de 30 cepas resistentes a carbapenemenes por producción de carbapenemasa, MALDI-TOF MS detectó picos de degradación del meropenem en 29 aislados. De las 94 cepas no productoras de carbapenemasas (39 aislados de Ps. Aeruginosa), el espectrómetro de masas detectó moléculas de meropenem intactas en 92 casos. Obteniendo una sensibilidad del 96.67 % y una especificidad del 97.87% para este método.
Así mismo, diferentes antibióticos pertenecientes al grupo de betalactámicos han sido probados por Bruker Daltonik GmbH (Katrin Sparbier et al, Journal Clinical of Microbiology, 2012) para detectar cepas de enterobacterias resistentes por presencia de betalactamasas. Utilizaron ampicilina, piperacilina, ceftazidima, cefotaxima, imipenem, meropenem y ertapenem en distintos aislados de Escherichia coli y Klebsiella pneumoniae, Comprobaron que dependiendo de que la cepa fuese productora de betalactamasa o no se producía hidrólisis del antibiótico en cuestión, obteniendo un espectro específico.
Sin duda alguna, la gran limitación actual de esta metodología es la imposibilidad de detectar carbapenemasas por impermeabilidad de membrana, que no evita la confirmación mediante métodos clásicos de todos los casos en los que no se detecten carbapenemasas mediante esta tecnología. Aún así, debido a la trascendencia que en infecciones graves por Ps. aeruginosa supone instaurar un tratamiento adecuado, de confirmarse nuestros resultados en nuevas series, disponer de esta información en unas horas servirá para mejorar el tratamiento en estos pacientes, además de colaborar para los programas de optimización del uso de antimicrobianos en nuestro centro (10), prevenir la selección de cepas multirresistentes, y apoyar la vigilancia y control de las infecciones intrahospitalarias causadas por este tipo de bacterias.
BIBLIOGRAFÍA
- Lambert PA. Mechanism of antibiotic resistance in Pseudomonas aeruginosa. J R Soc Med. 2002; 95:22-6.
- Bush K. Alarming β-lactamase-mediated resistance in multidrugresistant Enterobacteriaceae.Curr. Opin.Microbiol.2010; 13:558 -564.
- Livermore DM. Multiple mechanisms of Antimicrobial Resistance in Pseudomonas aeruginosa: Our worst Nightmare? Clin Infect Dis. 2002; 34: 634-640.
- E Bessède, M. Anglagre, Y. Delagarde, S. Sep Hieng, A. Ménard and F. Mégraud. Matrix-assisted laser-desorption/ionization BIOTYPER: experience in the routine of a University hospital. Clin Microbiol Infect. 2011;17: 533–538.
- Burckhardt I, Zimmermann S. Using matrix-assisted laser desorption ionization–time of flight mass spectrometry to detect carbapenem resistance within 1 to 2.5 hours. J. Clin. Microbiol.2011;49: 3321–3324.
- Hrabak J, Walkova R, Studentova V, Chudackova E, Bergerova T. Carbapenemase activity detection by matrix-assisted laser desorption ionization–time of flight mass spectrometry. J. Clin. Microbiol.2011; 49:3222–3227.
- Giske CG, Gezelius L, Samuelsen Ø, Warner M, Sundsfjord A, Woodford N. A sensitive and specific assay for detection of MBL and KPC in K. pneumoniae, with the use of meropenem disks supplemented with aminophenylboronic acid, dipicolinic acid and cloxacillin. Clin Microbiol Infect. 2011;17: 552-556.
- Sparbier K, Schubert S, Weller U, Boogen C, Kostrzewa M. Matrix-Assisted Laser Desorption Ionization-Time of Flight Mass Spectrometry-Based Functional Assay for Rapid Detection of Resistance against b-Lactam Antibiotics. J. Clin.Microbiol. 2012, 50(3):927.
- Schubert S, Weinert K, Wagner C, Gunzl B, Wieser A, Kostrzewa M. Novel, improved sample preparation for rapid, direct identification from positive blood cultures using matrix-assisted laser desorption/ionization time-of-flight (MALDI-TOF) mass spectrometry. J. Mol. Diagn. 2011; 13:701–706.
- Rodríguez-Baño J, Paño-Pardo JR, Álvarez-Rocha L, Asensio Á, Calbo E, Cercenado E et al. Programas de optimización de uso de antimicrobianos (PROA) en hospitales españoles: documento de consenso GEIH-SEIMC, SEFH y SEMPSPH. Enferm Infecc Microbiol Clin.2011.doi:10.1016.
INFORMACIÓN DEL ARTÍCULO
Autora para la correspondencia: Raquel Camacho-Luque. Servicio de Microbiología Clínica. Hospital Universitario San Cecilio. Avd. Doctor Oloriz s/n, 18012 – Granada. España. raquelcluque@hotmail.com – Telf. 958023879