Original
Evaluación microscópica de la transdiferenciación de las células madre de la gelatina de Wharton hacia urotelio
Microscopic evaluation of transdifferentiation of Wharton’s jelly stem cells to urothelium
Actual. Med. 2014; 99: (793): 132-135 DOI: 10.15568/am.2014.793.or03
Enviado: 09-10-2014
Revisado: 20-12-2014
Aceptado: 29-12-2014
RESUMEN
Introducción: Las células madre de la gelatina de Wharton (HWJSC) han demostrado su capacidad de transdiferenciarse hacia piel, tejido neural, hueso, tejido adiposo, cartílago y recientemente córnea. En este estudio evaluamos los cambios en la morfología de las (HWJSC) hacia la morfología del urotelio, y así abrir la posibilidad de su utilización en el manejo de patologías urológicas.
Material y métodos: Se cultivaron células uroteliales que posteriormente fueron expandidas, a partir de estos cultivos primarios de urotelio se obtuvo el medio condicionado. Este medio condicionado se utilizó para inducir cambios morfológicos de los cultivos primarios de las HWJSC hacia urotelio. Dichos cambios morfológicos se evaluaron a los 7 y 14 días.
Resultados: Los resultados revelaron que las HWJSC cultivadas con Amniomax® (Gibco BRL) presentaron forma fusiforme a los 7 días, mientras que las HWJSC que se encontraban con medio condicionado a los 7 y 14 días, presentaron cambios morfológicos tipo poligonal característico de las células uroteliales.
Discusión: Las HWJSC inducidas en nuestro trabajo con medio condicionado, revelan que los cambios morfológicos de tipo poligonal y en adoquín característicos de las células uroteliales, son más acentuados al día 14. Estos hallazgos morfológicos revelan la potencialidad de las células del cordón umbilical para diferenciarse hacia endotelio.
Palabras clave: células madre de la gelatina de Wharton, células uroteliales
ABSTRACT
Introduction: Wharton’s jelly (HWJSC) stem cells have demonstrated their ability to differentiate into skin, neural tissue, bone, fat, cartilage and, more recently, cornea. We assessed changes in the morphology of HWJSC differentiated to the urothelial lineage, which may open the possibility of using these cells for the management of urological pathologies.
Material and methods: Urothelial cells were cultured and expanded ex vivo and a conditioned medium was obtained from these cultures. This conditioned medium was used to induce morphological changes in primary cultures of HWJSC to urothelium. These morphological changes were assessed at 7 and 14 days.
Results: The results revealed that HWJSC cultured in Amniomax® (Gibco BRL) had spindle-like morphology after 7 days, whereas HWJSC cultured in conditioned medium for 7 and 14 days showed cobblestone and polygonal-type morphological changes that were typical of urothelial cells.
Discussion: The use of conditioned medium on HWJSC was able to induce characteristic urothelial-like morphological changes, especially at day 14. These findings reveal the potentiality of these umbilical cord cells to differentiate into endothelial cells.
Keywords: mother of Wharton’s jelly cells, urothelial cells
Leer Artículo Completo
INTRODUCCIÓN
La ingeniería tisular es una rama de la investigación, que en las últimas décadas ha desarrollado grandes avances en el tratamiento de diversas patologías (1). Los tratamientos convencionales son insuficientes e incluso en algunos casos generan importantes complicaciones para el mismo paciente. Una de las ramas que se ha visto beneficiada en este ámbito ha sido la urología. En la que la posibilidad de creación de tejidos artificiales con células madre abre nuevos campos de aplicación terapéutica. Actualmente, los tratamientos de cirugía urológica reconstructiva especialmente de vejiga, están enfocados a la utilización de segmentos de tejidos gastrointestinales, ya sea para el reemplazo o la reparación de la vejiga (1-3). La utilización de implantes de tejidos gastrointestinales en el sistema urinario disminuye sin embargo la tolerancia de estos tejidos al contacto con la orina y produce graves riesgos tales como producción excesiva de moco, urolitiasis, trastornos metabólicos y malignización (1-3). De este modo, la ingeniería tisular se presenta como una alternativa viable y prometedora en el tratamiento de pacientes que requieran reemplazo o reparación de la vejiga urinaria. La mayoría de los sustitutos vesicales desarrollados hasta el momento se basan en la utilización de cultivos autólogos de células uroteliales (1). En este sentido, se ha descrito, la escasa capacidad proliferativa de estas células in vitro, lo cual dificulta la creación de tejidos artificiales vesicales. En este contexto, las células madre mesenquimales de la gelatina de Wharton (HWJSC) podrían representar una fuente alternativa para la construcción de estos tejidos. Las propiedades inmunomoduladoras (4-6), su capacidad de transdiferenciación en los tres linajes embrionarios (7-11), así como su alta tasa de expansión, convierten a esta estirpe celular en una fuente de células madre idónea para su utilización en protocolos de ingeniería tisular, como se ha demostrado en la construcción de distintos tejidos como son córnea y piel (7-8, 10). El presente trabajo tiene por objeto el estudio de los cambios morfológicos que presentan las HWJSC inducidas hacia urotelio, utilizando un nuevo medio condicionado.
MATERIAL Y MÉTODOS
Obtención de cultivos primarios de células uroteliales y células madre de la gelatina de Wharton.
En primer lugar, para la generación de cultivos primarios de células uroteliales de la vejiga humana, se utilizó la técnica de explante a partir de pequeños fragmentos de vejiga, de acuerdo con los protocolos establecidos al respecto. Una vez obtenidos los fragmentos de tejido vesical, las células uroteliales se cultivaron en frascos de cultivo de 25 cm2 con medio de cultivo (QC) durante 7 y 14 días. El medio de cultivo QC estaba constituido por HAM-F12: 150 ml; DMEM: 300 ml; suero bovino fetal: 50 ml; penicilina-estreptomicina: 50 UI/ml; adenina: 24 µg/ml; insulina: 5 µg/ml; triyodotironina: 1.3 ng/ml; toxina colérica: 8.3 ng/ml; hidrocortisona: 0.4 µg/ml; factor de crecimiento epidérmico: 10 ng/ml. En el caso de los cultivos primarios de células de HWJSC, se obtuvieron pequeños fragmentos de cordón umbilical y se sometieron a digestión enzimática con colagenasa tipo I (Gibco BRL Life Technologies) y tripsina 0,5 g / L-etilendiaminotetraacético ácido solución de 0,2 g / l (EDTA) (Gibco BRL). Las células disgregadas se mantuvieron en medio de cultivo Amniomax® (Gibco BRL) bajo condiciones de cultivo estándar durante 7 y 14 dias (7).
Inducción de cambios morfológicos de tipo urotelial en células HWJSC.
Para llevar a cabo el proceso de inducción de las HWJSC, se utilizó medio condicionado (MC) obtenido a partir de cultivos primarios de células uroteliales. Para la obtención del MC fue necesario mantener las células uroteliales en medio de cultivo QC durante nueve días. Posteriormente, el medio QC fue obtenido, filtrado, y suplementado con 10% de suero bovino fetal (SBF), 0,1% factor de crecimiento epidermal (EGF) y 1% de antibióticos, pasando a denominarse MC. El proceso de cambio en la morfología de las HWJSC hacia urotelio se realizó utilizando 20.000 HWJSC, las cuales se cultivaron en MC durante 7 y 14 días. Como control, se utilizaron 20.000 HWJSC cultivadas en medio Amniomax® (Gibco BRL) con el objeto de mantener el perfil de indiferenciación de dichas células.
Evaluación microscópica del proceso de transdiferenciación urotelial de las HWJSC.
En el presente trabajo, se realizo una evaluación microscópica de las células uroteliales cultivadas en medio QC, así como de las HWJSC cultivadas en medio Amniomax® y las cultivadas con MC durante 7 y 14 días. Para la evaluación microscópica, se utilizó un microscopio Nikon eclipse Ti-U, con el cual se tomaron imágenes con aumento de 10X de todos los cultivos celulares. Posteriormente, todas las imágenes fueron procesadas y analizadas utilizando el software ImageJ 1.48v. En primer lugar, se calculó el porcentaje de confluencia en dos imágenes correspondientes a cada grupo de estudio: urotelio cultivado con QC, HWJSC cultivado con MC y de control las HWJSC cultivado con Amniomax®. En segundo lugar, se calculó el diámetro celular en las dos dimensiones (largo y ancho) de 20 células correspondientes a cada uno los grupos experimentales. El análisis se llevó a cabo calculando el valor promedio y la desviación estándar de cada grupo. En este sentido, la evaluación de la capacidad de transdiferenciación de las HWJSC hacia urotelio se analizó mediante la identificación de cambios morfológicos utilizando los datos previamente descritos.
RESULTADOS
Obtención de cultivos primarios de células uroteliales y células madre de la Gelatina de Wharton.
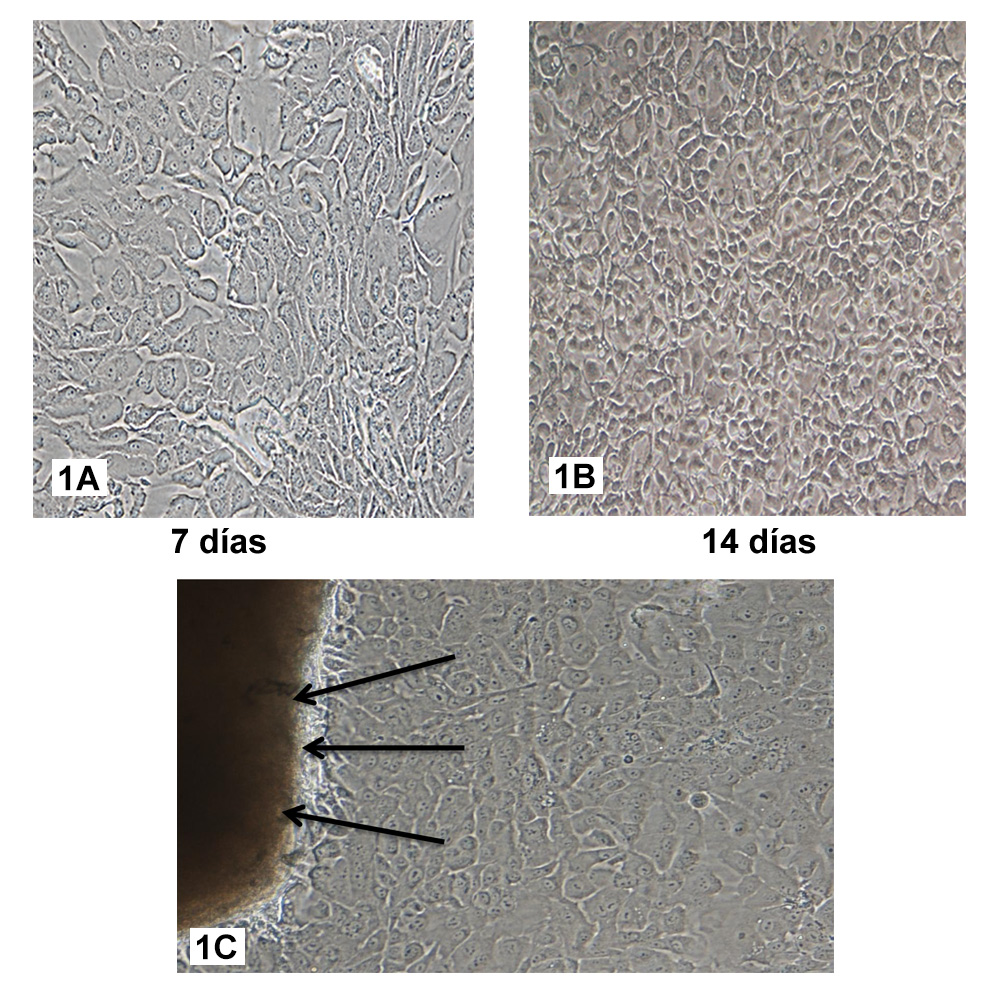
Tras la obtención de las biopsias de vejiga humana, se lograron obtener cultivos primarios correspondientes a la capa mucosa, concretamente, de células uroteliales. Como primeros hallazgos encontramos que los cultivos primarios de células uroteliales presentaban una confluencia del 75% a los 7 días y mayor del 90% a los 14 días de cultivo, cuyo crecimiento era en colonias (Figuras 1A y 1B). Además, como se observa en la Figura 1C, las células uroteliales crecieron alrededor del explante, tomando una morfología poligonal que les da la característica forma de “adoquines” cuyas dimensiones fueron 6,614±1,049 x 3,966±1,051 µm a los 7 días y 5,293±1,011 x 4,057±1,300 µm a los 14 días. Como segundo hallazgo, encontramos que las HWJSC cultivadas en medio Amniomax®, utilizadas como control en este trabajo, presentaron una confluencia del 85% a los 7 días y mayor del 90% a los 14 días. También se observó una rápida capacidad de proliferación in vitro. El análisis morfológico reveló que a los 7 y 14 días presentaban morfología fusiforme (Figuras 2A y 2B) cuyas dimensiones fueron 9,046± 2,831 x 1,868±0,685 µm a los 7 días postcultivo y 9,172±2,006 x 1,568±0,566 µm a los 14 días, a diferencia de la morfología de las células uroteliales.
Figuras 1A. Células uroteliales cultivadas con medio QC a los 7 días. 1B Células uroteliales cultivadas con medio QC a los 14 días. Figura 1C. Células uroteliales cultivadas con medio QC presentando crecimiento alrededor del explante. (Flechas negras).
Figura 2A. HWJSC a los 7 días de cultivo con medio Amniomax®.
Figura 2B. HWJSC a los 14 días de cultivo con medio Amniomax®.
Evaluación del cambio morfológico de las HWJSC hacia urotelio inducido por medio condicionado.
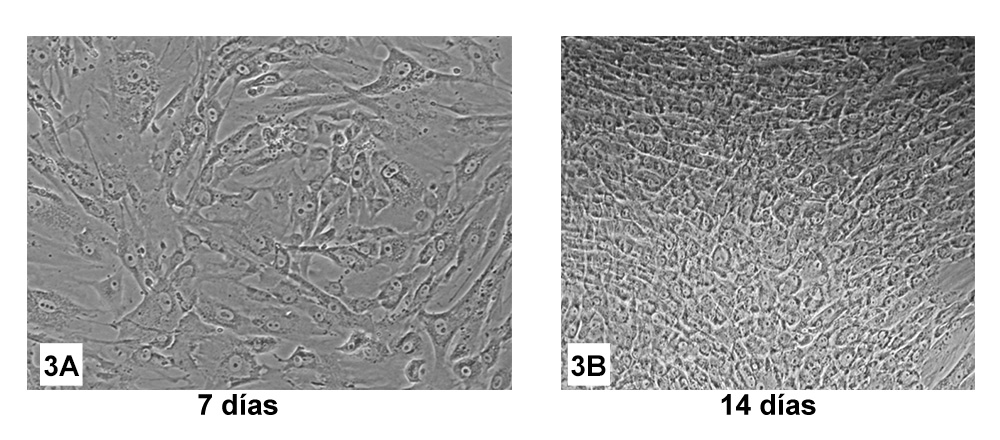
En la evaluación de las HWJSC que se encontraban inmersas en medio condicionado (MC), se observó que estas células presentaron una confluencia del 70% a los 7 días y una confluencia mayor del 95% a los 14 días. Además de los hallazgos anteriores, la cuantificación de las dimensiones celulares reveló a los 7 días, la persistencia de una morfología elongada y fusiforme con unas dimensiones medias de 13,138±4,876 x 5,020±1,750 µm. Por otra parte, a los 14 días, presentaron morfología poligonal o en “adoquín”, cuyas dimensiones fueron 3,711± 0,990 x 4,035± 1,419 µm (Figura 3A y 3B), similar a las células uroteliales humanas.
Figuras 3A células HWJSC bajo medio condicionado a los 7 días. 3B células HWJSC bajo medio condicionado a los 14 días.
DISCUSIÓN
Las HWJSC se han sugerido como una novedosa posibilidad para el tratamiento de diferentes patologías urológicas, gracias a sus propiedades inmunomoduladoras (4-6), a su capacidad de diferenciación en los tres linajes embrionarios (7-11), a su alta tasa de expansión, así a como a su fácil obtención. A pesar de todas estas capacidades, el uso de las HWJSC en patologías urológicas aun es muy limitado, y esto se debe a que la transdiferenciación de las HWJSC hacia urotelio aún no ha sido suficientemente investigada.
Estudios previos como el de Wu S. y col (3) y Kang HH. y col (2) demostraron que el uso de medios condicionados era capaz de inducir cambios morfológicos de las células madre mesenquimales hacia urotelio. En el presente trabajo corroboramos que las células HWJSC que se encontraban bajo medio condicionado presentaron cambios morfológicos poligonales en “adoquín”, similares a los de las células uroteliales. Cabe resaltar que a los 7 días postinducción con el medio condicionado, los cambios diferenciativos hacia la estirpe endotelial aún eran muy leves. Este hallazgo es similar al encontrado por Tian H. y col (12), quienes describen que la morfología de las células madre mesenquimales de la médula ósea a los 7 días postinducción con medios condicionados presentaban cambios poligonales leves en su morfología, pero que no alcanzaban las características clásicas de las células uroteliales. En nuestro estudio encontramos que a los 14 días postinducción, las HWJSC que se encontraban en el medio condicionado adquirieron una morfología poligonal en “adoquín”, característica de las células uroteliales, corroborado por los cambios en sus dimensiones, los cuales fueron similares a las dimensiones morfológicas de las células uroteliales. A pesar de esto, se observaron algunas zonas donde las HWJSC aún presentaban una leve morfología fusiforme. Estos hallazgos son de relevancia, ya que estudios previos como los realizados por Wu S. y col (3) con células madre del cordón umbilical diferenciadas hacia urotelio utilizando medios condicionados, demostraron que a los 14 días postinducción, empezaban a tomar una leve morfología poligonal característica de las células uroteliales. De igual forma, estudios realizados por Shi J. y col (13) utilizando medios condicionados indujeron la transdiferenciación de células madre mesenquimales del tejido adiposo hacia urotelio a los 14 días postinducción, y encontraron que el 25%-50% de estas células presentaban cambios morfológicos poligonales característicos de las células uroteliales. Comparativamente con los hallazgos realizados por Shi J. y col (13) y Wu S. y col (3), la morfología poligonal o en “adoquín” a los 14 días postinducción es más evidente en nuestros resultados. Ello demuestra que las HWJSC inducidas con el medio condicionado utilizado en este trabajo desarrollan una mayor eficiencia de transdiferenciación hacia urotelio y una mayor similitud morfológica, como demuestran los datos morfométricos en comparación con los hallados por Shi J. y col (13).
CONCLUSIÓN
En este trabajo demostramos que las HWJSC tienen la capacidad de adquirir una morfología similar a las células uroteliales cuando se encuentran inducidas por medio condicionado. Este hallazgo es compatible con los presentados en estudios previos que demuestran la capacidad de las HWJSC para transdiferenciarse a células de otra linaje como es el urotelio. Sin embargo, es necesario realizar estudios posteriores, donde se investigue en profundidad la capacidad de transdiferenciacion de las WHJSC, en los cuales se detallen los cambios que se presentan a nivel molecular.
REFERENCIAS
- Yoo JJ, Olson J, Atala A, Kim B. Regenerative Medicine Strategies for Treating Neurogenic Bladder. Int Neurourol J. 2011; 15: 109-19.
- Kang HH, Kang JJ, Kang HG, Chung SS. Urothelial differentiation of human amniotic fluid stem cells by urothelium specific conditioned medium. Cell Biol Int. 2014; 38: 531-7.
- Wu S, Chenga Z, Guohua L, Xinfeng Z, Liang Z, Yingjian Z, Jiang Z. Urothelial differentiation of human umbilical cord-derived mesenchymal stromal cells in vitro, Analytical Cellular Pathology. 2013; 36: 63–9.
- Dae-Won K, Meaghan S, Kazutaka S, Paolina P, Sung-Don K, Borlongan CV. Wharton’s Jelly-Derived Mesenchymal Stem Cells: Phenotypic Characterization and Optimizing Their Therapeutic Potential for Clinical Applications. Int. J. Mol. Sci. 2013; 14: 11692-712.
- Jyothi Prasanna S, Sowmya Jahnavi V. Wharton’s Jelly Mesenchymal Stem Cells as Off-The-Shelf Cellular Therapeutics: A Closer Look into their Regenerative and Immunomodulatory Properties. The Open Tissue Engineering and Regenerative Medicine Journal. 2011; 4: 28-38.
- Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses. Blood 2005; 4: 1815-1.
- Garzón I, Miyake J, González-Andrades M, Carmona R, Carda C, Sánchez-Quevedo Mdel C, Campos A, Alaminos M. Wharton’s jelly stem cells: a novel cell source for oral mucosa and skin epithelia regeneration. Stem Cells Transl Med. 2013; 2: 625-32.
- Zhang L, Zhang HT, Hong SQ, Ma X, Jiang XD, Xu RX. Cografted Wharton’s jelly cells-derived neurospheres and BDNF promote functional recovery after rat spinal cord transection. Neurochem Res 2009; 34: 2030-9.
- Garzón I, Pérez-Köhler B, Garrido-Gómez J, Carriel V, Nieto-Aguilar R, Martín-Piedra MA, García-Honduvilla N, Buján J, Campos A, Alaminos M. Evaluation of the cell viability of human Wharton’s jelly stem cells for use in cell therapy. Tissue Eng Part C Methods. 2012; 18: 408-19.
- Garzon I, Martin-Piedra MA, Alfonso-Rodriguez C, González-Andrades M, Carriel V, Martínez-Gómez C, Campos A, Alaminos M; Generation of a biomimetic human artificial cornea model using Wharton´s jelly mesenchimal stem cells; invest ophthalmol cis sci. 2014; 55: 40713-83.
- Mitchell KE, Weiss ML, Mitchell BM, Martin P, Davis D, Morales L, Helwig B, Beerenstrauch M, Abou-Easa K, Hildreth T, Troyer D, Medicetty S. Matrix cells from Wharton’s jelly form neurons and glia. Stem Cells. 2003; 21: 50-60.
- Tian H, Bharadwaj S, Liu Y, Ma PX, Atala A, Zhang Y. Differentiation of human bone marrow mesenchymal stem cells into bladder cells: potential for urological tissue engineering. Tissue Eng Part A. 2010 ; 16: 1769-79.
- Shi JG, Fu WJ, Wang XX, Xu YD, Li G, Hong BF, Hu K, Cui FZ, Wang Y, Zhang X. Transdifferentiation of human adipose-derived stem cells into urothelial cells: potential for urinary tract tissue engineering. Cell Tissue Res. 2012; 347:737–46.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Boris Damian Jaimes Parra. e-mail: bdamian2009@hotmail.com