Original
Métodos de Planificación que Establecen la Estrategia de Resección de MAVs cerebrales
Planning Methods for safety surgical removal of brain AVMs
Actual. Med. 2017; 102: (800). Supl. 14-48
RESUMEN
Objetivos. Describir el proceso de planificación prequirúrgica para la extirpación de malformaciones vasculares (MAVs) cerebrales.
Métodos. Se revisan quince casos de malformaciones arteriovenosas cerebrales operadas por los autores en 2015 y 2016. Se han realizado procedimientos de planificación prequirúrgica basados en técnicas de imagen: TAC craneal, angio-TAC, resonanica magética (RM), angioRM, RM-funcional, angiografía, ecografía y neuronavegador intraoperatorio.
Diez malformaciones tenían antecedente de sangrado. El resto presentaban crisis epilépticas asociadas a la MAV. Seis casos eran grado I de Spetzler-Martin (S-M); siete eran S-M II; uno, S-M III; y uno, S-M V. Seis se operaron de manera urgente. Cinco de ellos por sangrado y uno por embolización de la vena de drenaje.
Resultados. No se registró ningún sangrado intraoperatorio de la MAV. En todos los casos la lesión fue extirpada por completo y sin que el paciente presentara focalidad asociada a la cirugía. En un caso ocurrió fenómeno de break-through que prolongó el postoperatorio pero no conllevó déficits neurológicos permanentes.
Conclusiones. El TAC craneal constituye la prueba inicial que determina si ha habido sangrado. El angio-TAC identifica aferencias arteriales y su trayecto; morfología del nidus; y características de los drenajes venosos. Y todo ello en relación a las estructuras óseas. La RM y RM-funcional muestran el tamaño del nidus, localización y elocuencia del área. La angio-RM identifica los surcos implicados. La angiografía determina la dinámica de la malformación. La ECO intraoperatoria localiza en tiempo real el nidus y los hematomas.
La planificación consiste en cotejar la información de la malformación obtenida mediante todas las pruebas con el campo quirúrgico. La extirpación de una MAV requiere de una estrategia quirúrgica establecida con antelación. Su ejecución estricta va aparejada a una cirugía rápida, sin fenómenos de sangrado y con buen resultado clínico
Palabras clave: MAV cerebral, neurocirugía vascular, planificación digital prequirúrgica.
ABSTRACT
Objectives. To describe the preoperative planning process for brain arterio-venous malformations (AVMs).
Methods. Fifteen cases of brain AVM were operated by the authors during 2015 and 2016. Preoperative planning procedures were performed in all cases: cranial CT scan, CT-angio (CTA) scan, magnetic resonance image (MRI), MR-angio (MRA), functional MRI (f-MRI), angiography (DSA), intraoperative ultrasound and neuronavegation.
Ten AVMs presented with haemorrhage. Five cases presented with seizures. Six cases were Spetzler-Martin (S-M) grade I; seven, S-M II; one, S-M III; and one, S-M I. Six emergent surgeries were performed. Five of them presented large hematoma and one case suffered accidental vein of drainage embolization.
Results. No intraoperative nidus bleeding was registered. The AVM was completely resected in all cases and no extra neurological deficits were detected after surgical removal. One case presented postoperative break-though phenomenon but no neurological deficits were achieved at patient discharge.
Conclusions. Cranial CT scan shows if the AVM has bled. CTA scan identifies arterial feeders, nidus morphology, and venous drainages. It also represents the relationship between de AVM’s components and the skull base. MRI and f-MRI show the nidus shape, location and eloquence of the surrounded brain. MRA identifies the gyri. DSA studies the dynamic of the AVM. Finally, intraoperative ultrasound locates in real time the nidus and hematoma.
Preoperative planning consists on comparing the information collected from the image techniques with the surgical field. Safety AVM removal requires a thorough preoperative strategy and the strict performance of the surgery according to the plan.
Keywords: brain AVM, neurovascular surgery, digital preoperative planning.
Leer Artículo Completo
INTRODUCCIÓN
Las malformaciones arteriovenosas cerebrales (MAVs) suponen un problema de salud de graves consecuencias cuando sangran o se hacen sintomáticas. El tratamiento mediante las distintas modalidades, entre ellas la quirúrgica, es complejo y requiere de una planificación minuciosa. Describimos las pruebas de imagen que utilizan los autores para el diseño de la cirugía, minimizar los riesgos de complicaciones intraoperatorias y asegurar el buen resultado quirúrgico.
La edad de diagnóstico de las MAVs cerebrales típicamente se encuentra entre 20-40 años. Así, en la cohorte de Ondra et al. (1) constituída por 160 MAVs y con una observación prospectiva de 33 años, se determinó la siguiente forma de presentación: hemorragia, 71%; crisis sin evidencia de hemorragia, 24%; y cefalea u otros síntomas neurológicos menores, 5%.
Se determinó que el riesgo anual de sangrado es del 4% (independiente de la manera de presentación); y que el riesgo anual de muerte es 1%. Siendo el riesgo anual de muerte o alta morbilidad del 2.7%.
Según The New York Islands AVM Hemorrhage Study, el intervalo medio entre presentación y evento hemorrágico es del 7,7 años (2). El diagnóstico anual de MAV cerebral se establece en 1.34/100.000 habitantes-año. La incidencia de primera hemorragia es 0.51/100.000 personas-año. Y la incidencia de primera hemorragia por MAV según The Northern Manhattan Stroke Study es 0.55/100.000 personas-año (3).
Atendiendo al Columbia AVM Database, el mayor riesgo de hemorragia se atribuye a las MAVs de localización profunda en cerebro, las que poseen exclusivo drenaje venoso profundo, y las que cursan con presentación con hemorragia. Además, el riesgo asociado con estos factores es aditivo. Con riesgo anual de sangrado de 0,9% —si la MAV no presenta ninguno de estos factores— a 34.4% si presenta los tres (4).
En adición, los auneurismas asociados a las MAVs aumentan el riesgo de sangrado. Así, el RR de sangrado es 2.28 en pacientes con aneurismas intranidales; y de 1,88 para pacientes con aneurismas en aportes arteriales (5). También influye el reclutamiento de venas, si existe estenosis venosa, reflujo venoso, o drenaje venoso profundo.
En líneas generales se establecen las siguientes ecuaciones para determinar el riesgo de rotura de la MAVs cerebrales (6, 7):
- Riesgo de rotura = 1- (riesgo de no hemorragia)(expectativa de vida)
- Riesgo de rotura = 105 – edad del paciente.
- Otros factores que también condicionan son la genética y factores hemodinámicos.
El tratamiento principal de una MAV cerebral es su resección quirúrgica. En ocasiones, bien por complejidad de la malformación o por ubicación en áreas elocuentes, el riesgo de morbilidad quirúrgica es elevado y se establecen otros tratamientos alternativos tales como la radiocirugía estereotáxica y la embolización del nidus. El establecimiento de estrategias combinadas también constituye el tratamiento idóneo en casos seleccionados. Sin duda, la estrategia de seguimiento y tratamiento debe ser establecida por un equipo multidisciplinar integrado por neurocirujanos y neurorradiólogos intervencionistas.
Para ayudar a la toma de decisiones las MAVs cerebrales se clasifican según la Tabla 1 atendiendo a tamaño, localización y patrón del drenaje venoso.
Finalmente, hay que valorar la historia natural de la enfermedad en cada paciente, el riesgo del tratamiento seleccionado, la experiencia del neurocirujano y de la institución. La decisión final es del paciente y debemos guiarlo en la toma de decisión.
*sensitiva, motora, corteza visual, hipotálamo, tálamo, cápsula interna, pedúnculos cerebelosos, y núcleos del cerebelo.
** con excepción de hemorragias recurrentes, déficit neurológico progresivo, síntomas atribuibles a robo, y aneurismas de flujo.
Tabla 1. Clasificación Spetzler-Martin de las malformaciones vasculares cerebrales.
MATERIAL Y MÉTODO
Se revisan 15 casos de malformaciones arteriovenosas cerebrales operadas entre 2015 y 2016 en la institución a la que pertenecen los autores. Diez malformaciones tenían antecedente de sangrado. El resto presentaban crisis epilépticas asociadas a la MAV. Seis casos eran grado I de Spetzler-Martin (S-M); siete eran S-M II; 1, S-M III; y 1, S-M V. Seis se operaron de manera urgente. Cinco de ellos por sangrado y uno por embolización de la vena de drenaje tras haberse determinado tratamiento combinado (embolización seguida de resección quirúrgica).
De los 15 pacientes operados, catorce fueron estudiados con TAC craneal simple. Ocho pacientes con angio-TAC craneal (todos los casos operados de manera urgente). A ocho pacientes se les realizó RM cerebral. A cinco, angio-MR cerebral. Dos casos fueron estudiados con RM cerebral funcional. Y trece casos fueron estudiados con angiografía cerebral.
RESULTADOS
Con las pruebas disponibles para cada paciente se llevó a cabo una planificación suficiente para cada acto quirúrgico. El objetivo era conocer previamente al inicio de la cirugía la localización exacta del nidus y cuáles eran las aferencias que debíamos buscar e interrumpir en fases iniciales, qué arterias debíamos respetar, y dónde hallar los drenajes principales que se deben mantener permeables hasta el final de la resección.
Todas las MAVs fueron extirpadas por completo y en ningún caso se registró sangrado intraoperatorio del nidus. Ningún paciente experimentó al alta ninguna nueva focalidad neurológica aunque un paciente sufrió un fenómeno de edema cerebral y sangrado diferido del lecho asociado a fallo local de la autoregulación (break-through) (9) que prolongó el postoperatorio pero no conllevó déficits neurológicos permanentes.
En todos ellos se han realizado procedimientos de planificación de la exéresis lesional basados fundamentalmente en técnicas de imagen arriba mencionada. Intraoperatoriamente se añadió la ecografía.
DISCUSIÓN
La extirpación de una malformación vascular cerebral requiere de una cuidada planificación de la cirugía encaminada a la eliminación completa del nidus malformativo. Además, es necesario evitar que durante este procedimiento se produzca la rotura del propio nidus, de venas de drenaje o arterias aferentes. El sangrado puede ser muy profuso y llegar a impedir incluso la extirpación de la malformación generando déficits neurológicos graves. Así, la técnica quirúrgica precisa de una correcta identificación del nidus, interrumpir sólo las ramas arteriales que lo nutren y no otras que irriguen áreas cerebrales adyacentes. Las venas de drenaje se ha de respetar hasta el final para que, durante toda la disección de la malformación, sigan permeables y no aumente la presión dentro de la lesión malformativa.
Pero tras la craneotomía y apertura de la duramadre, no todos los componentes citados de la malformación aparecen evidentes y un estudio previo de la anatomía de la malformación y la región del cerebro en la que se encuentra se hace indispensable para la resección exitosa.
Antes incluso de indicar el tratamiento de la malformación debemos conocer su ubicación y la elocuencia del área en la que asienta, anticipando así la posible morbilidad tras la extirpación. También se requiere conocer la morfología del nidus, si es compacto o difuso; si tiene un predominio fistuloso (con rápido paso de sangre desde las aferencias arteriales a los drenajes venosos) o plexal. Finalmente, se necesita saber si hay edema , hipertensión intracreaneal, hidrocefalia, áreas parenquimatosas con hemosiderina, coágulo fresco, hematoma licuado o encefalomalacia.
Sobre los drenajes venosos es imperativo conocer si son superficiales o al sistema venoso profundo (constituido por venas cerebrales internas, ampolla de Galeno y venas basales de Rosenthal). Del mismo modo, se debe conocer el número de drenajes, si existe estenosis, éctasis venoso, o ingurgitación de venas vecinas. Es esencial identificar cuáles son los drenajes principales y secundarios.
En cuanto a las aferencias arteriales se requiere conocer los territorios y troncos arteriales de los que derivan; su tipo: aferencia terminal (directa a la malformación), arterias de paso que dan múlitples y pequeñas ramas a la malformación, arterias perforantes, y arterias vecinas no involucradas en la MAV. Gran importancia en el riesgo de sangrado a lo largo de la historia natural lo tiene el hecho de que existan aneurismas de flujo en arterias aferentes o en arterias intranidales.
Con toda esta información se pretende dar respuesta a la necesidad de tratamiento y a su modalidad. En cuanto al acto quirúrgico nos ayuda a determinar: cómo posicionar al paciente, el diseño de la craneotomía, la estimación del riesgo de sangrado intraoperatorio, y cuál es el “ángulo de ataque” a la MAV. Y detalles microquirúrgicos tales como: la relación y adherencias con la base del cráneo, hoz, tentorio, ventrículos; determinar los surcos cerebrales a disecar; planificar la disección pial… En definitiva, si seremos capaces de extirpar con éxito la MAV.
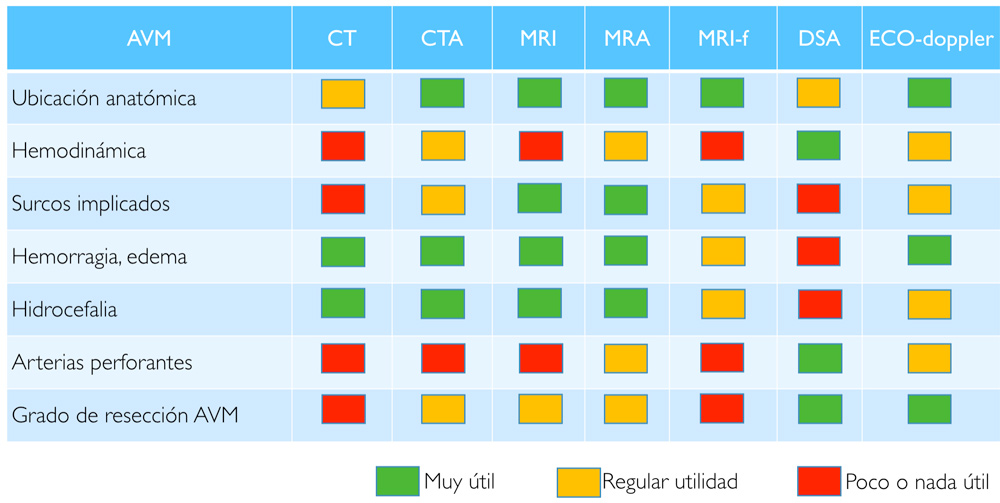
Las pruebas de imagen con las que se obtiene esta información son: angiografía cerebral, resonancia magnética (RM), angio-RM, RM funcional, TAC, angioTAC, y ECO-doppler intraoperatorio.
Angiografía:
Es la prueba diagnóstica que aporta información dinámica de la malformación. En la fase arterial, nos indica cuáles son los aportes que nutren la malformación, de qué territorio vascular provienen y si existen aneurismas. Informa también sobre la morfología del nidus, si tiene un alto componente fistuloso. Identifica si hay fenómenos de robo desde otros territorios. Finalmente, permite realizar un estudio selectivo inyectando contraste directamente desde una de las aferencias a la malformación. Incluso se puede inyectar propofol y explorar la función del territorio irrigado por esa aferencia indicándonos si la oclusión de la misma conllevaría un déficit neurológico. Del mismo modo, un test de oclusión de una arteria estudia la tolerancia del cerebro a su cierre.
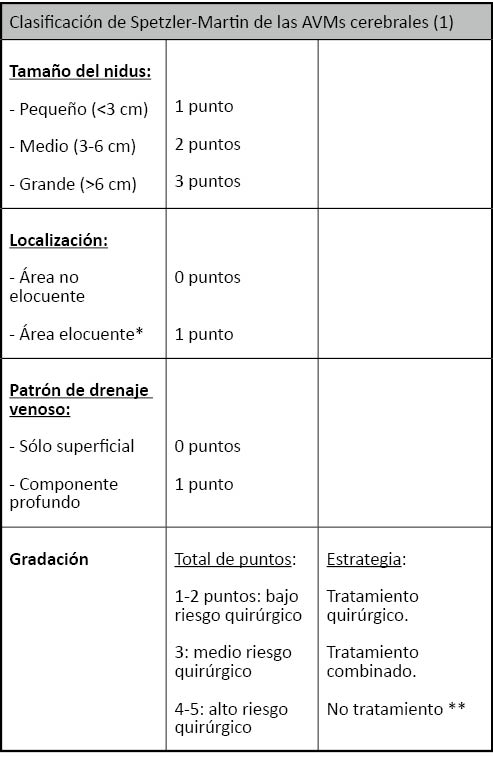
En cuanto a los drenajes venosos, la angiografía permite conocer su número, si son superficiales o profundos, la permeabilidad de senos venosos y si existe ingurgitación o estenosis venosas. Figura 1.
Figura 1. Correspondencia entre los hallazgos angiográficos y el campo quirúrgico. La estrella muestra el nidus y la flecha una aferencia arterial profunda rama de la arteria cerebral posterior derecha.
Resonancia magnética (RM):
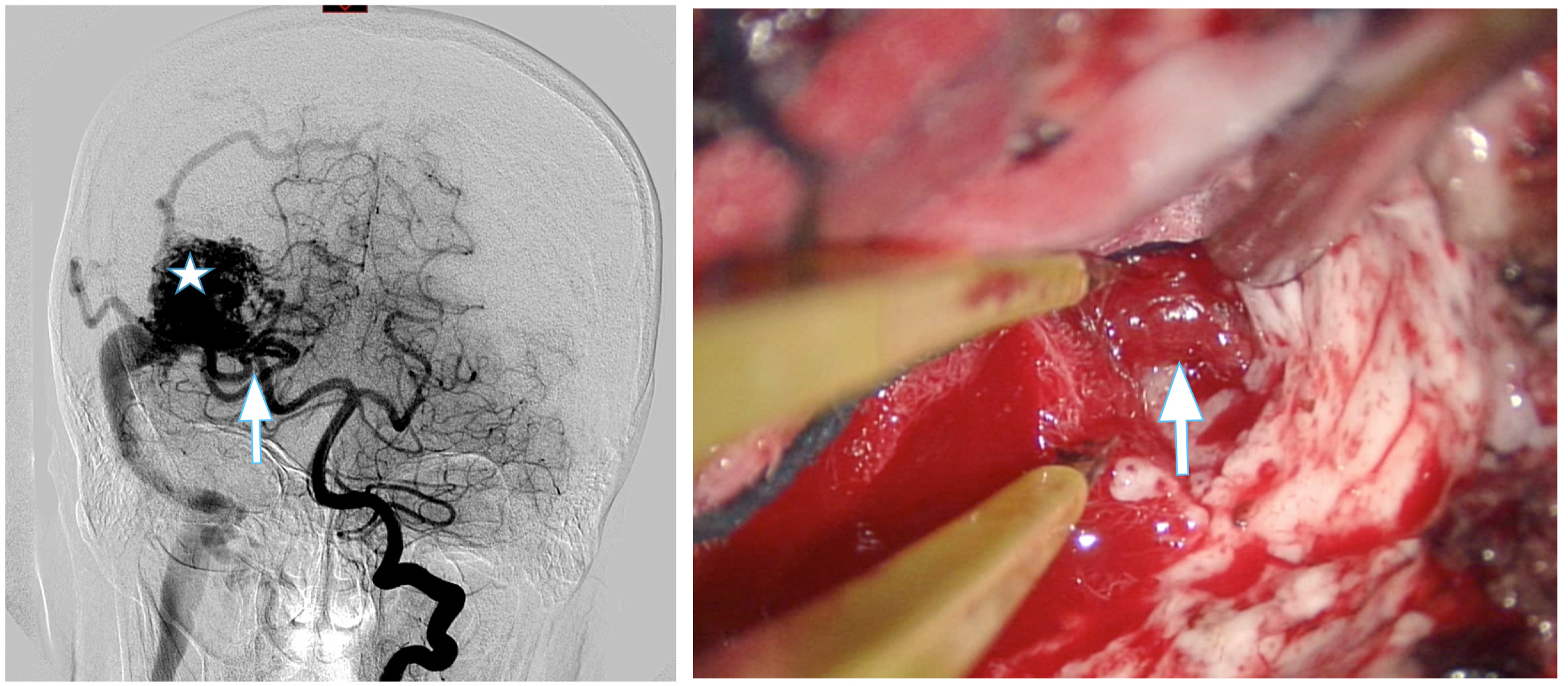
Coloca los hallazgos de la angiografía en el cerebro. Es decir, nos dice en qué área anatómica se encuentra la lesión. Además de si existe edema, hemorragia y su antigüedad, si encefalomalacia, o infarto. Relaciona la MAV con la hoz, tentorio, ventrículos, tronco del encéfalo, pares craneales, y otras estructuras vasculares vecinas. Permite su uso en la neuronavegación intraoperatoria. Figura 2.
Figura 2. Se muestra la correspondencia entre RM cerebral y el campo quirúrgico. La estrella muestra la principal vena de drenaje que es identificada en el campo quirúrgico. Con su sección al final de la disección concluye la extirpación.
Angio-RM:
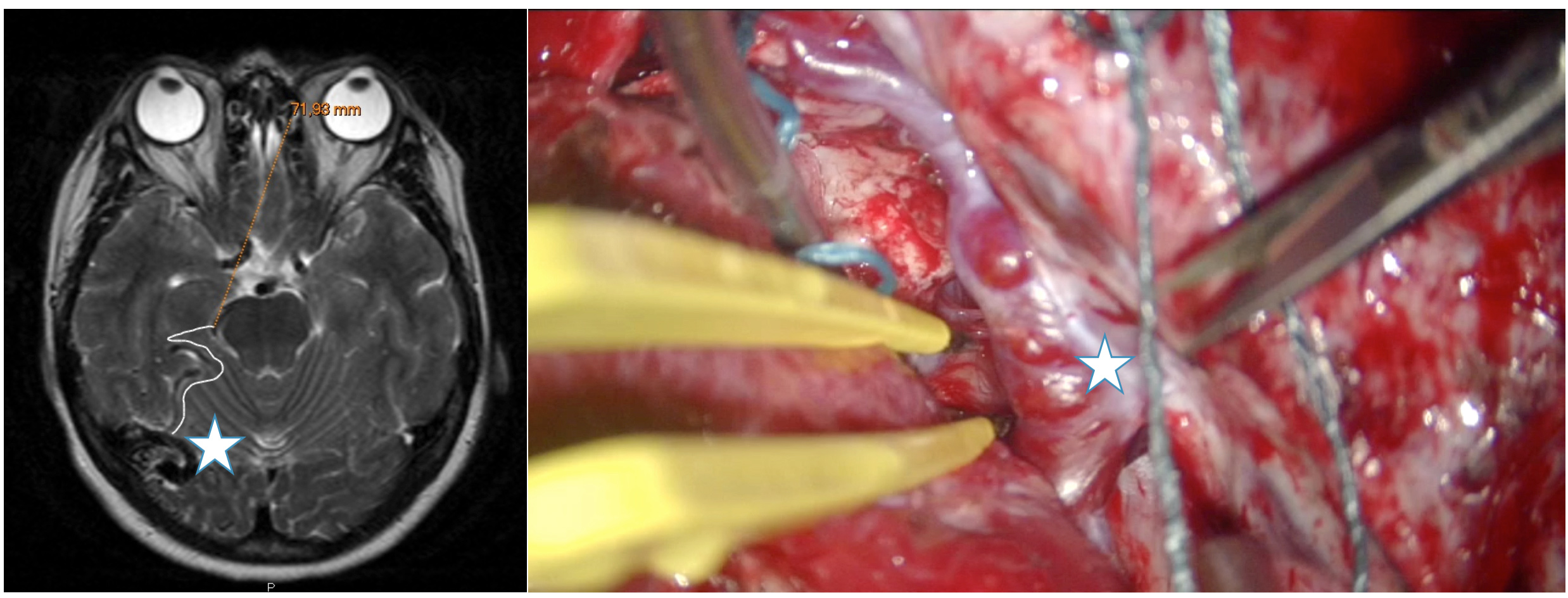
Representa a la vez todo el árbol vascular arterial y venoso, si bien los vasos más pequeños no son tan bien caracterizados como en la arteriografía. Permite la reconstrucción digital tridimensional del nidus, sus aferencias y drenajes. También se pueden reconstruir los surcos cerebrales y ventrículos y exponer su relación con los componentes de la MAV. En definitiva, representa una imagen anatómica real del campo quirúrgico. Al igual que la RM, puede ser utilizada para la neuronavegación intraoperatoria. Figura 3a.
RM-funcional:
Identifica las distintas áreas funcionales cerebrales y su relación con la MAV. Nos da información del grado de elocuencia del área en la que asienta la lesión. Figura 3b.
Figura 3. A. Se muestra la reconstrucción de la angio-RM cerebral mostrándose un pequeño nidus (estrella) localizado adyacente al área motora del lenguaje. B. Una RM funcional del mismo paciente durante la lectura. Nótese la cercanía del nidus al área motora del lenguaje.
TAC:
Debido a su disponibilidad y rapidez suele ser la primera prueba diagnóstica que se realiza cuando se sospecha un problema neurológico agudo. Nos informa si existe una hemorragia reciente o tardía. Si bien un nidus pequeño puede pasar desapercibido, lesiones de mayor tamaño o con calcificaciones pueden poner sobre la pista de una lesión ocupante de espacio cerebral que requiere de mejor estudio con una RM. Una vez tratada la MAV, identifica complicaciones postquirúrgicas de tipo hemorrágico o isquémico. Informa de la ubicación de clips microquirúrgicos, material de embolización, o microcatéteres que puedan haber sido desprendidos en el proceso de embolización. También estudia el tamaño de los ventrículos.
Angio-TAC:
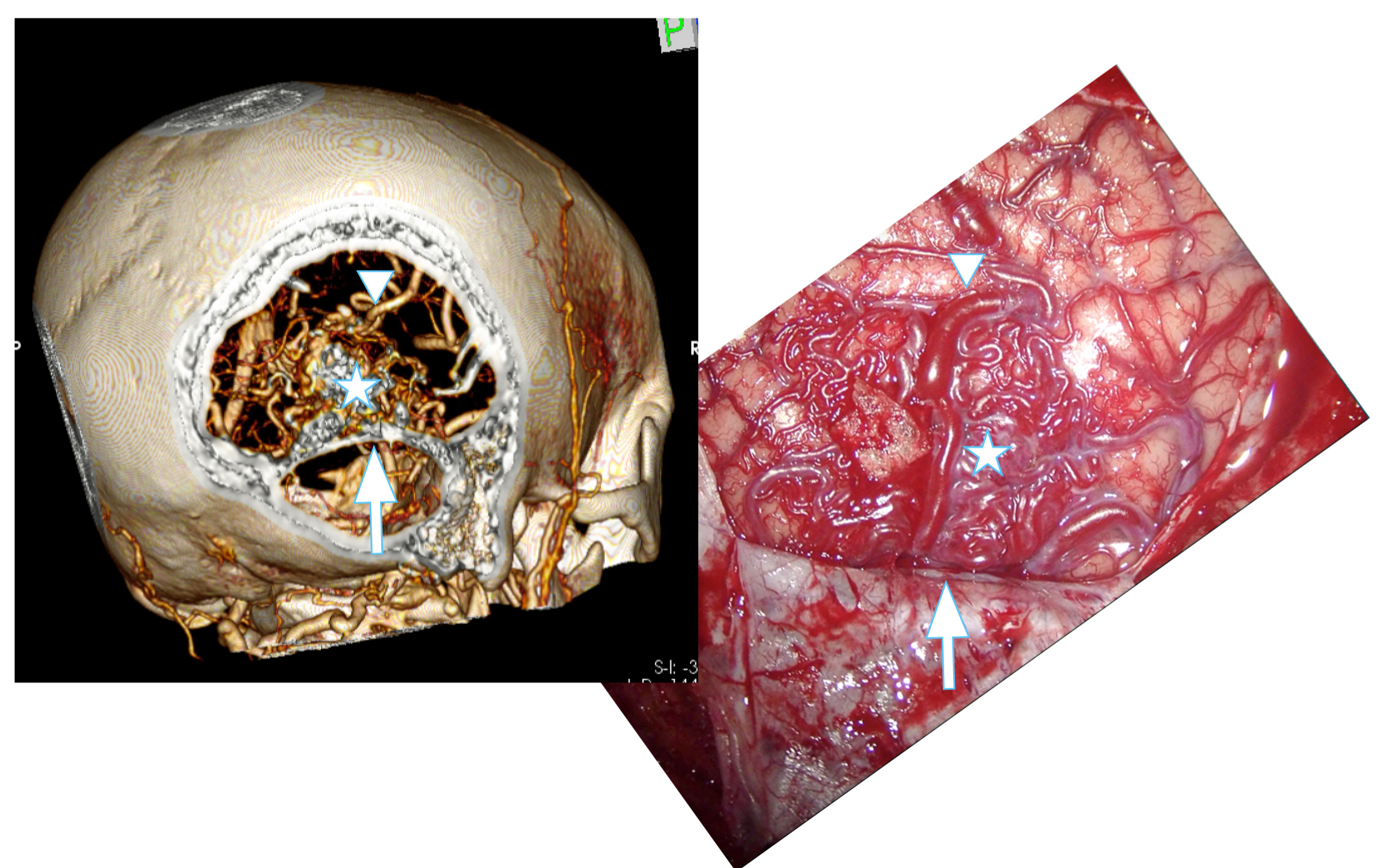
Al TAC añade que dibuja con precisión las aferencias y drenajes de manera similar a la angio-RM. La principal ventaja de esta prueba es que muestra con detalle la relación de todos los componentes de la MAV con la base del cráneo y las estructuras óseas. Además, goza la misma inmediatez y disponibilidad de realización que el TAC craneal a diferencia de la angio-RM y la angiografía en la mayoría de instituciones. En los casos de sangrado de la malformación que requieren cirugía evacuadora urgente constituye la prueba de elección ya que nos informa de la ubicación exacta del coágulo a extirpar y su relación con la MAV. Expone también las características de la malformación que permiten establecer la indicación de extirpación y la estrategia de la resección. Las imágenes pueden reconstruirse tridimensionalmentede y usarse en la neuronavegación intraoperatoria. Figura 4.
Ecografía intraoperatoria:
Determina en tiempo real, y una vez expuesto el campo quirúrgico, la ubicación del hematoma así como evaluar su grado de evacuación. También mide el flujo arterial del nidus y las principales venas de drenaje indicando el grado de desconexión del nidus de sus aferencias arteriales.
Figura 4. Se muestra la correspondencia entre la reconstrucción tridimensional del angio-TAC craneal y el campo quirúrgico. Se ha realizado una craneotomía occipital derecha supra e infratentorial. La flecha muestra el tentorio. La estrella muestra el nidus malformativo.
Cada prueba diagnóstica nos muestra la malformación desde una perspectiva diferente (Tabla 2). Debemos procesar toda esa información para que en el momento del acto quirúrgico vayamos al encuentro de las aferencias terminales que hemos de interrumpir respetando las arterias de paso; disequemos el nidus cuya estructura, tamaño y localización ya conocemos; respetemos las áreas elocuentes vecinas; y sepamos identificar los drenajes cuya relación con el nidus ya conocemos de antemano y que interrumpiremos sólo en los últimos compases de la resección.
Tabla 2. Comparativa de la utilidad de cada una de las pruebas diagnósticas (filas) para cada aspecto relevante de una MAV (columnas).
CONCLUSIONES
El TAC craneal constituye la prueba inicial que determina si ha habido sangrado. El angio-TAC confirma la malformación, identifica aferencias arteriales, su origen y trayecto; morfología del nidus; y características de los drenajes venosos. Y todo ello en relación a las estructuras óseas del cráneo y su base. La RM cerebral y RM funcional identifican el tamaño del nidus, localización y elocuencia del área. La angio-RM y su reconstrucción tridimensional permite identificar los surcos por donde discurren los vasos implicados. La angiografía determina el carácter fistuloso o plexal de la malformación, su dinámica y la existencia de aferencias o drenajes no identificados inicialmente en las pruebas anteriores. La ecografía intraoperatoria localiza en tiempo real el nidus y los hematomas.
El objetivo final es cotejar la información anatómica y dinámica vascular de la malformación obtenida mediante todas estas pruebas con el campo quirúrgico. La extirpación de una MAV requiere de una estrategia quirúrgica establecida con antelación. Su ejecución estricta va aparejada a una cirugía rápida, sin fenómenos de sangrado y con buen resultado clínico.
REFERENCIAS
- Ondra SL, Troupp H, George ED, Schwab K. The natural history of symptomatic arteriovenous malformations of the brain: a 24-year follow-up assessment. J Neurosurg. 1990;73(3):387-91.
- Stapf C, Mast H, Sciacca RR, Berenstein A, et al. New York Islands AVM Study Collaborators. The New York Islands AVM Study: design, study progress, and initial results. Stroke. 2003;34(5):e29-33.
- Stapf C, Labovitz DL, Sciacca RR, Mast H, Mohr JP, Sacco RL. Incidence of adult brain arteriovenous malformation hemorrhage in a prospective population-based stroke survey. Cerebrovasc Dis. 2002;13(1):43-6.
- Stapf C, Mast H, Sciacca RR, et al. Predictors of hemorrhage in patients with untreated brain arteriovenous malformation. Neurology. 2006;66(9):1350-5.
- Stapf C1, Mohr JP, Pile-Spellman J, et al. Concurrent arterial aneurysms in brain arteriovenous malformations with haemorrhagic presentation. J Neurol Neurosurg Psychiatry. 2002;73(3):294-8.
- Conger A, Kulwin C, Lawton MT, Cohen-Gadol AA. Diagnosis and evaluation of intracranial arteriovenous malformations. Surg Neurol Int. 2015;6:76.
- Lawton MT. Seven AVMs : tenets and techniques for resection. Thieme: New York; 2014.
- Spetzler RF, Ponce FA. A 3-tier classification of cerebral arteriovenous malformations. Clinical article. J Neurosurg. 2011;114(3):842-9.
- Awad IA, Magdinec M, Schubert A. Intracranial hypertension after resection of cerebral arteriovenous malformations. Predisposing factors and management strategy. Stroke. 1994;25(3):611-20.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Alicia Godoy-Hurtado. Telf 660084911 e-mail: aliciagodoyhurtado@gmail.com