Caso Clínico
Infección protésica tardía tratada mediante sustitución por aloinjerto arterial criopreservado en paciente joven
Vascular prosthetic infection treated with criopreserved arterial graft in a young patient
Actual. Med. 2014; 99: (793). Supl. 13-40
RESUMEN
Las infecciones protésicas por gérmenes poco virulentos pueden manifestarse de manera muy tardía, siendo con frecuencia los resultados analíticos anodinos. Su tratamiento representa un desafío, sobre todo en pacientes carentes de vena apta para bypass.
Mujer de 44 años, fumadora e insuficiente renal en diálisis. Hace 14 años se le realiza bypass femoro-femoral de dacron tras traumatismo de arteria iliaca común derecha en cirugía de transplantectomía. Acude a urgencias por pseudoaneurisma anastomótico derecho, confirmado con eco-Doppler y TC. Analítica anodina y hemocultivos extraídos negativos.
Se realiza sustitución in situ del bypass tras desbridamiento, empleando aloinjerto arterial criopreservado (carece de vena autóloga apta). En los cultivos intraoperatorios crece S. epidermidis y S. capitis, pautándose vancomicina en las diálisis. Al mes el bypass sigue permeable, sin complicaciones.
La sustitución in situ empleando aloinjerto arterial criopreservado es una opción segura y duradera en aquellos pacientes con infección protésica, en ausencia de material autólogo apto.
Palabras clave: Criopreservación, infección, aloinjerto, pseudoaneurisma
ABSTRACT
Late graft infections caused by little virulent pathogens tipically manifests years after the procedure. Treatment is complicated in those patients without autologous vein for bypass.
44 year old female, smoker and cronic kidney failure in dialysis. Cross femoral dacron bypass was performed 14 years ago, after accidental section of rigth iliac artery during transplantectomy. She came to the emergency with an anastomotic aneurysm (right), confirmed by ultrasonography and contrast-enhanced computed tomography. Laboratory tests and blood culture are negative. In situ graft replacement using a cryopreserved arterial allograft is performed. The patient is treated with vancomicin during and after the hospital stay. No complications after a month.
In situ graft replacement using a cryopreserved arterial allograft is a secure option in patients with graft infection and without autologous material for bypass.
Keywords: Cryopreservation, infection, allograft, pseudoaneurysm
Leer Artículo Completo
Introducción
El uso de prótesis vasculares conlleva un riesgo no despreciable de infección de las mismas, provocando cuadros con riesgo vital para el paciente y cuyo tratamiento es complejo, requiriendo una reintervención quirúrgica en la gran mayoría de los casos. Cuando la infección protésica es producida por gérmenes poco virulentos, suele manifestarse de manera tardía (después de los cuatro meses, aunque a veces años después de la implantación), siendo con frecuencia los resultados analíticos negativos. Su tratamiento mediante antibioticoterapia y sustitución in situ es el tratamiento preferido en la actualidad, aunque puede representar un desafío en pacientes carentes de vena apta para bypass, como el caso que se presenta a continuación.
Caso Clínico
Presentamos el caso de una paciente de 44 años, fumadora, con antecedente de infarto agudo de miocardio hace 3 años (en seguimiento por cardiología) e insuficiente renal en programa de hemodiálisis, portadora de catéter venoso yugular permanente después de múltiples fístulas no funcionantes en ambos miembros superiores. Es intervenida de transplante renal hace 14 años, y meses después, de transplantectomía por rechazo agudo del injerto, seccionándose de manera accidental la arteria iliaca común derecha. Se realiza entonces bypass venoso ilio-femoral con trombosis del mismo en el postoperatorio inmediato, por lo que se vuelve a intervenir de urgencia realizándose finalmente un bypass fémoro-femoral de dacron.
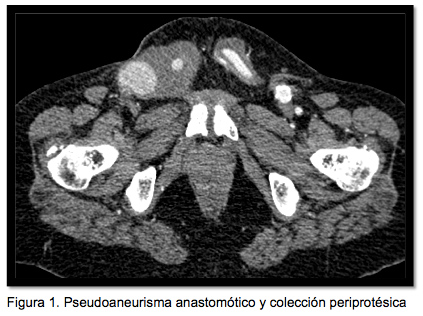
Acude a urgencias por presentar una masa de unos 4 cm de diámetro, dolorosa y pulsátil en ingle derecha, de una semana de evolución, con crecimiento significativo en las últimas 24 horas. Estable hemodinámicamente con tensión arterial de 140/80 mmHg, frecuencia cardíaca 97 lpm, saturación arterial 98% y temperatura 37.3ºC. En la analítica extraída en urgencias destaca una PCR 6.8mg/L, 10.500 leucocitos con 81% de polimorfonucleares y resto de alteraciones bioquímicas propias de la insuficiencia renal de la paciente. Se extraen hemocultivos que son negativos. Se le realiza eco-Doppler donde se observa el bypass permeable, con imagen de pseudoaneurisma anastomótico de 43×39 mm en la ingle derecha (receptora). Se solicita TC donde se confirma dicho hallazgo y se observa la prótesis intensamente calcificada y con colección líquida periprotésica en todo su trayecto (figura 1).
Figura 1: Pseudoaneurisma anastomótico y colección periprotésica.
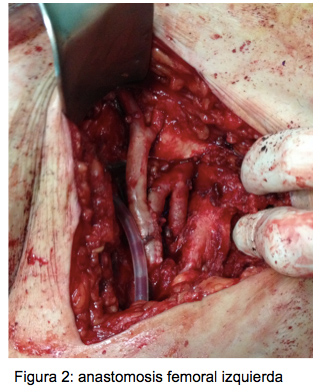
Se decide intervenir a la paciente al día siguiente, para realizar una sustitución in situ del bypass tras desbridamiento de la pared arterial y tejidos circundantes. Se utiliza para ello aloinjerto arterial criopreservado, dada la inexistencia de vena autóloga apta (figura 2). Se toman cultivos intraoperatorios, en los que se aíslan dos microrganismos: S. epidermidis y S. capitis. Desde el ingreso (antes del resultado de los cultivos intraoperatorios) se pauta vancomicina en las diálisis de forma empírica. Desarolla un hematoma suprapúbico no complicado durante el postoperatorio, sin otras complicaciones. Es dada de alta al 6º día postoperatorio con heridas de buen aspecto y pulsos distales bilaterales, sin parámetros sépticos sistémicos ni analíticos, dejándose pautada vancomicina en diálisis durante 30 días más.
Figura 2: Anastomosis femoral izquierda.
En la revisión al mes de la cirugía, el bypass de aloinjerto arterial criopreservado sigue permeable, con heridas cicatrizadas y de buen aspecto, sin signos de infección.
Discusión
La infección protésica ocurre entre el 0,2 y el 5% de los pacientes e implica un riesgo vital para el paciente así como de pérdida de extremidad . Es más probable en presencia de algunas circunstancias, entre las que se encuentran la cirugía de urgencia, la tunelización subcutánea, las anastomosis a nivel femoral, las reintervenciones, el sexo femenino [1], la insuficiencia renal crónica y la presencia de catéteres durante largos periodos (todas ellas presentes en nuestra paciente). Aunque S. aureus sigue siendo el germen más implicado, las infecciones protésicas por S. epidermidis son cada vez más frecuentes en los últimos años. [1] A diferencia de S. aureus y otros gérmenes gram negativos más virulentos, la infección por S. epidermidis (2) suele producir síntomas de forma tardía en forma de aneurismas anastomóticos, fístulas injerto-cutáneas, acúmulos de líquido alrededor del injerto, con ausencia de signos sistémicos sépticos (fiebre, leucocitosis…).
Existen distintas clasificaciones en función del momento de aparición (precoz o tardía, siendo los 4 meses el límite), según la relación con la infección postoperatoria de la herida (clasificación de Szilagyi)[3] o la amplitud de la afectación del injerto (clasificación de Bunt). El uso de terapia de presión negativa en infecciones de la herida con exposición de la prótesis a bajas presiones (Szilagyi III) o la cobertura muscular (con músculo sartorio) (4,5) supone una modalidad de tratamiento en aquellos casos sin signos sépticos sistémicos, con anastomosis intactas, obteniendo buenos resultados.
En casos de injertos extracavitarios, el signo inicial de infección suele ser la inflamación local, celulitis, una fístula que comunique con la piel o un pseudoaneurisma anastomótico, como en nuestro caso. Ya se ha comentado la manifestación más o menos precoz según el germen implicado. A veces pueden observarse signos de embolia séptica en la extremidad afecta, en forma de petequias, y es importante revisar cuidadosamente todas las heridas buscando una masa o absceso (6).
Para el diagnóstico por imagen la combinación de ecografía y TC con contraste (donde se observan signos como colecciones líquidas o gaseosas peri-injerto, pseudoaneurismas, abscesos) es suficientemente sensible a este nivel, reservándose la gammagrafía con leucocitos marcados para los casos más dudosos o para determinar la extensión de la infección (7).
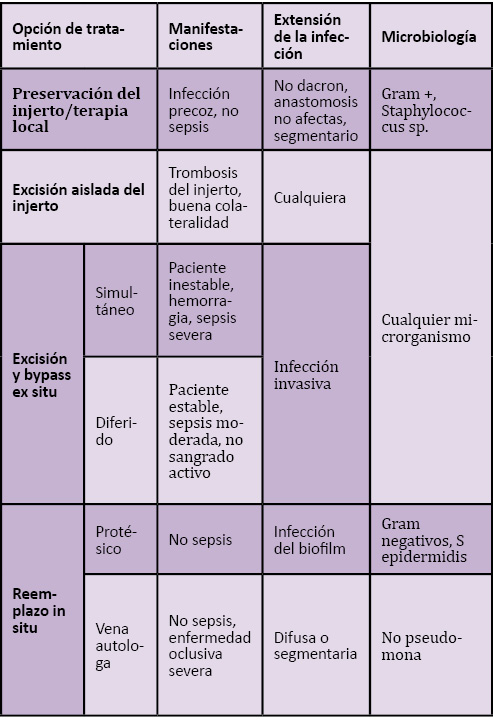
El tratamiento se basa en el empleo de antibióticos y la cirugía. Como antibióticos, el tratamiento empírico de las infecciones por estafilococos coagulasa negativos es la vancomicina. Otros antibióticos, como daptomicina, linezolid y algunas cefalosporinas de primera o segunda generación tienen actividad potencial frente a estos gérmenes. La sustitución in situ del injerto asociada a un desbridamiento agresivo es preferible a la conservación del injerto o a la extirpación simple (tabla 1). La conservación del injerto sólo puede plantearse en casos de injertos permeables que no sean de dacron, si las anastomosis no están infectadas, no existe una infección polimicrobiana con gram – (sobre todo Klebsiella, Proteus, Pseudomona spp) y no hay signos clínicos de sepsis(6). La extirpación simple es sólo posible en casos de claudicación intermitente o con una colateralidad suficiente que asegure la perfusión de la extremidad (6).
Tabla 1. Criterios para el manejo de pacientes con infección protésica (6)
La sustitución in situ por vena autóloga obtiene los mejores resultados, aunque en pacientes que carecen de vena apta, puede emplearse aloinjerto arterial criopreservado o material protésico impregnado en antibióticos en último término(8). El empleo de aloinjertos requiere un seguimiento a largo plazo dada la posibilidad de rotura o degeneración tardía del mismo en aproximadamente el 17% y estenosis/oclusión en 20%, según las series (9,10).
BIBLIOGRAFÍA
- Siracuse JJ, Nandivada P, Giles KA, et al. Prosthetic graft infections involving the femoral artery. J Vasc Surg 2013: 57(3); 700-705
- L. Legout, B. Sarraz-Bournet, P.V. D’Elia, et al. Characteristics and prognosis in patients with prosthetic vascular graft infection: A prospective observational cohort study. Clin Microbiol Infect 2012: 18; 352–358
- Szilagyi D.E., Smith R.F., Elliot J.P., et al. Infection in arterial reconstruction with synthetic grafts. Ann Surg 1972; 176:321.
- H.H. Dosluoglu, D.K. Schimpf, R. Schultz, G.S. Cherr. Preservation of infected and exposed vascular grafts using vacuum assisted closure without muscle flap coverage. J Vasc Surg 2005: 42;989–992
- Berger P, Bie D, Moll FL, Borst GJ. Negative pressure wound therapy on exposed prosthetic vascular grafts in the groin. J Vasc Surg 2012; 56(3): 714-720.
- Back M. Graft infections. En: Cronenwett J, Johnston K. Rutherford’s Vascular Surgery. 8ºed. 2014: p654-73.
- Leroy O, Meybeck A, Sarraz-Bournet B, et al. Vascular graft infections. Curr Opin Infect Dis 2012; 25:154.
- Bandyk DF, et al: Expanded application of in situ replacement for prosthetic graft infection. J Vasc Surg 2001; 34:411.
- Bisdas T, et al. Eight-year experience with cryopreserved arterial homografts for the in situ reconstruction of abdominal aortic infections. J Vasc Surg 2010; 52:323.
- Brown KE, et al: Arterial reconstruction with cryopreserved human allografts in the setting of infection: a single-center experience with mid-term follow-up. J Vasc Surg 2009; 49:660.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Jose Damián Herrera Mingorance. e-mail: damianherrer@gmail.com