Original
Obtención y caracterización de un modelo de cartílago a partir de hidroxiapatita, quitosano y policaprolactona
Synthesis and characterization of a cartilage model using hydroxyapatite, chitosan and polycaprolactone
Actual. Med. 2017; 102: (800): 7-12 DOI: 10.15568/am.2017.800.or01
Enviado: 18-03-2017
Revisado: 14-04-2017
Aceptado: 25-04-2017
RESUMEN
Introducción: El cartílago es una estructura clave que permite el deslizamiento de los huesos evitando la fricción y su desgaste. Sus propiedades biomecánicas vienen determinadas por la interacción entre sus componentes principales. La elevada incidencia de lesiones condrales ha originado un amplio número de estudios con objeto de tratar los defectos del cartílago articular. Las estrategias terapéuticas ensayas incluyen la terapia celular, el uso de biomateriales y, especialmente, la ingeniería tisular, que ha demostrado un gran potencial para tratar estos defectos. Se han ensayado diversos biomateriales para constructos tisulares e hidrogeles, incluyendo polímeros naturales y sintéticos.
Objetivos: El objetivo de este trabajo es presentar un método de obtención de cartílago articular basado en quitosano (CS), policaprolactona (PCL) e hidroxiapatita (HA).
Material y métodos: Se utilizaron como biomateriales de base el quitosano, policaprolactona y la hidroxiapatita. Se sintetizó una biomatriz de quitosano y policaprolactona mediante el método de disolución en medio ácido y la hidroxiapatita con productos químicos habituales. Se realizaron varias mezclas con distintas proporciones de quitosano, policaprolactona e hidroxiapatita y se evaluó su capacidad de absorción de agua, humedad, densidad, porosidad volumétrica y propiedades de procesamiento histológico, comparándose con los valores respectivos del cartílago articular normal.
Resultados: De las mezclas ensayadas, la mezcla 80CS/15PCL/5HA mostró una mayor similitud al cartílago normal en los parámetros medidos. Asimismo, esta mezcla presentó unas características aptas para el procesamiento histológico habitual.
Discusión: En este estudio se presenta un método sencillo y económico para obtener biomatrices basadas en quitosano, policaprolactona e hidroxiapatita. Para las proporciones ensayadas, la mezcla 80CS/15PCL/5HA presenta unas propiedades de gran interés para ser utilizada como modelo de cartílago articular artificial. En un futuro se caracterizarán otras propiedades biomecánicas y biológicas.
Palabras clave: hidroxiapatita, quitosano, policaprolactona, cartílago articular.
ABSTRACT
Introduction: Articular cartilage (AC) is a key structure in bone displacement that limits its friction and subsequent erosion. The biochemical properties of AC are determined by the interaction of its constituents. The high incidence of chondral lesions has led to a number of studies aimed to developing therapies to heal cartilage defects. These include cell therapy, use of biomaterials and, especially, tissue engineering, which has shown promising results. Many biomaterials, including natural and synthetic polymers, have been explored to develop tissue constructs and hydrogels.
Objectives: The present study aims to synthesize and evaluate bioscaffolds for articular cartilage made of chitosan (CS), polycaprolactone (PCL) and hyroxyapatite (HA).
Materials and methods: CS, PCL and HA were used as biomaterials. CS-PCL bioscaffold was synthesized by acid solution method and HA with common chemicals. Several blends were prepared with varying percentages of CS, PCL and HA. Water uptake capability, humidity, density, volumetric porosity and properties of histological processing were assessed and compared to the values of normal AC.
Results: For the assessed parameters and melts, the melt 80CS/15PCL/5HA showed the most similar values in comparison with normal cartilage. This melt also showed correct characteristics for standard histological processing.
Discussion: In this study we present a simple and inexpensive method to obtain bioscaffolds based on CS, PCL and HA. For the percentages explored, the melt 80CS/15PCL/5HA showed promising properties to be used as artificial AC model. More biomechanical and biological properties shall be assessed in the future.
Keywords: hydroxyapatite, chitosan, polycaprolactone, articular cartilage.
Leer Artículo Completo
INTRODUCCIÓN
El cartílago articular es un tejido altamente especializado que cubre la epífisis de los huesos largos enfrentados en las diartrosis y facilita su deslizamiento relativo gracias a sus propiedades físicas y biológicas, entre las que destaca su deformabilidad, resistencia a la compresión y deslizamiento a baja fricción (1-4). Desde el punto de vista anatómico, el cartílago articular humano es macroscópicamente blanco, brillante y firme, carece de vasos sanguíneos, linfáticos y nervios y presenta un grosor variable entre 2 y 4 mm. Desde el punto de vista histológico, el cartílago articular es un cartílago hialino con un componente celular y otro extracelular. Las células principales que conforman el cartílago articular son los condrocitos, de origen mesenquimal, que suponen un 5% del tejido cartilaginoso y se encargan de sintetizar, organizar y mantener la matriz extracelular (MEC) (5, 6). Por su parte, la MEC es una estructura tridimensional compleja compuesta por diversas sustancias, a saber, agua, colágeno (fundamentalmente tipo II), glicosaminoglicanos, proteoglicanos y otras proteínas. Desde el punto de vista biofísico, el cartílago articular es un material poroso y viscoelástico en el que se distinguen tres fases: una sólida (red de colágeno, 15-22% del peso húmedo, y proteoglicanos, 4-7% del peso húmedo), una líquida acuosa (< 80% del peso); y otra iónica (Na+, Ca2+, Cl-, etc.) (4-7). Estas tres fases actúan conjuntamente y permiten que el cartílago soporte elevadas cargas compresivas sin lesionarse (8).
Las lesiones del cartílago articular son muy frecuentes. Los estudios epidemiológicos señalan que aproximadamente el 6% de los adultos presentan una afección degenerativa de la rodilla, porcentaje que aumenta al 10% en personas mayores de 65 años (9). Varios estudios han informado de un porcentaje superior al 60% de lesiones condrales en artroscopias de rodilla (10, 11). Estas lesiones pueden evolucionar y producir artrosis, ocasionando un rápido deterioro del cartílago. Las lesiones articulares no suelen producirse por mecanismos directos sino por la variación de la magnitud o dirección de las cargas a lo largo del tiempo sobre un cartílago, cada vez, en peores condiciones. El proceso reparativo del cartílago articular consiste en el reemplazo de la MEC y las células, dañadas o perdidas, por nuevo tejido. Por la baja densidad celular y la incapacidad de los condrocitos para migrar hacia el defecto, la reparación requiere un considerable esfuerzo en un tejido ya de por sí comprometido por la falta de riego sanguíneo (12).
La elevada incidencia de lesiones condrales ha motivado la realización de un amplio número de estudios con objeto de desarrollar estrategias terapéuticas eficaces para subsanar los defectos del cartílago articular. La mayor parte de estos ensayos se han realizado sobre cartílago rotuliano, pues la patología articular es más frecuente a este nivel. Sin embargo, pese a los esfuerzos realizados hasta la fecha, la solución ideal aún parece lejos de llegar a la realidad clínica (13). Se han ensayado diversas matrices biodegradables con la finalidad de ser implantadas en la zona del defecto y favorecer el proceso de reparación condral (14, 15). En este contexto, actualmente han cobrado gran importancia los hidrogeles inyectables, especialmente los que incorporan nanopartículas de hidroxiapatita (nHA), pues potencian la integración del constructo condral a la matriz ósea (16, 17). En este sentido, el papel de la hidroxiapatita parece fundamental, hasta tal punto que algunos autores han propuesto utilizarla incluso para favorecer la integración cartílago-cartílago (en contenidos inferiores al 1%) (13, 17).
OBJETIVOS
El objetivo del presente trabajo es obtener biomateriales a partir de la combinación de distintas proporciones de hidroxiapatita (HA), quitosano (CS) y policaprolactona (PCL) con objeto de estudiar algunas propiedades de interés y realizar un estudio comparativo respecto al cartílago articular. De este modo, pretendemos caracterizar un potencial modelo de cartílago articular artificial.
MATERIAL Y MÉTODOS
Para caracterizar los biomateriales se utilizaron diversos productos químicos, incluyendo quitosano con un grado de deacetilación de aproximadamente un 85% (Sigma Aldrich) y policaprolactona (peso molecular 80.000 g mol-1, Sigma Aldrich). Los ácidos y bases utilizados fueron provistos por el Departamento de Histología de la Universidad de Granada y eran de grado analítico. La HA fue sintetizada en laboratorio.
1. Síntesis de HA
La HA fue sintetizada mediante una variante del método descrito en (18). Brevemente, se mezcló una disolución 0.6 M de fosfato de diamonio con una suspensión 1 M de hidróxido cálcico a partes iguales. El pH se ajustó a 11.5 mediante adición continua de hidróxido sódico y se activó la reacción química mediante calentamiento a 90 ºC durante una hora. Posteriormente se agitó la disolución durante 2 horas y se dejó en reposo 2 días, obteniéndose un precipitado de HA que fue posteriormente secado a 300 ºC durante 2 horas.
2. Obtención de la matriz de CS-PCL y adición de la HA sintetizada
La matriz de CS-PCL se obtuvo siguiendo una variante del método descrito en (19). Brevemente, el CS se disolvió en una disolución de ácido acético 1 M hasta obtener una disolución al 3% en peso/volumen. Por otro lado, la PCL se disolvió en una disolución de ácido acético glacial 1 M hasta obtener una disolución al 3% en peso-volumen. Las disoluciones obtenidas se mezclaron a 90 ºC durante 3 horas y se dejaron en reposo.
Para obtener los constructos finales se añadió disolución de HA ajustada para obtener una cantidad teórica del 5% en peso de HA en cada una de las combinaciones de CS-PCL. Finalmente se obtuvieron las mezclas, resumidas en la Tabla 1.
3. Caracterización del biomaterial
Se evaluaron varios parámetros de las mezclas obtenidas, a saber, humedad relativa, capacidad de absorción de agua, densidad, porosidad volumétrica y procesamiento histológico. Las técnicas y fórmulas utilizadas están descritas en la bibliografía (20-24). Se tomaron entre 5 y 10 muestras de cada mezcla obtenida y se anotaron, según procediese, los valores correspondientes.
3.1 Cálculo de la humedad relativa de las mezclas
Para calcular la humedad relativa de las mezclas obtenidas se utilizó un higrómetro resistivo (Mastech® MS6900). Las muestras tomadas presentaban una anchura superior a 20 mm (distancia entre los electrodos). Posteriormente se compararon los resultados de las cuatro mezclas con los del cartílago humano.
3.2 Cálculo de la capacidad de absorción de agua de las muestras
Para calcular la capacidad de absorción de agua se siguió un método similar al descrito en la bibliografía (25, 26). Brevemente, las muestras se secaron en la estufa a 37 ºC durante 48 horas y posteriormente se pesaron (W0). A continuación las muestras se sumergieron en agua destilada a 25 ºC durante 24 horas. Finalmente se secaron con papel absorbente para eliminar el exceso de agua de la superficie y se pesaron de nuevo (W1). La capacidad de absorción de agua se calculó mediante la fórmula:
ω = 100 × (W1 − W0) / W0
donde ω es el incremento porcentual final de peso de las muestras.
3.3 Cálculo de la densidad de las mezclas
Para calcular la densidad de las mezclas, en primer lugar se obtuvieron varias muestras de cada mezcla y se pesaron. A continuación se introdujeron en un recipiente con volumen conocido de agua y se midió la variación del rasado. La densidad se calculó a partir de la relación masa/volumen para cada muestra. Posteriormente se compararon los resultados de las cuatro mezclas con los del cartílago humano.
3.4 Cálculo de la porosidad volumétrica de las mezclas
Para calcular la porosidad volumétrica de las mezclas obtenidas, las muestras de cada mezcla se secaron a 105 ºC durante 30 minutos. A continuación se pesaron y se anotó el valor correspondiente. Posteriormente se sumergieron en agua destilada a 25 ºC durante 48 horas. Finalmente se sacaron del agua, se dejaron secar durante 2 horas y se pesaron. La porosidad volumétrica se calculó mediante la fórmula:
ρv = ρm / (ρm + ρf / ρm)
Donde ρm es la densidad del material seco; ρf es el valor de la densidad del agua (a 25 ºC y 1 atm, equivale a 1 mg/mL); y ρv es la proporción de huecos (expresada en tanto por uno).
Igualmente, se anotó la media de la porosidad para cada mezcla y se comparó con la del cartílago humano.
3.5 Evaluación del procesamiento histológico de las mezclas
Con el objetivo de estudiar si los biomateriales ensayados son capaces de someterse a un procesamiento histológico convencional, se procedió a evaluar en las mezclas obtenidas su aptitud en relación a los siguientes parámetros:
- Fijación: Las muestras fueron fijadas durante 24 horas a 4 ºC en formaldehido al 4% y en glutaraldehído al 2% y posteriormente se evaluó su integridad en función del grado de turbidez de medio, así como de la estructura macroscópica. Se consideró como «apto» para la fijación si no mostraba apenas deterioro y «no apto» si el medio se había vuelto turbio, pues esto es indicativo de que el material se ha deshecho parcial o totalmente, o si la muestra había perdido su integridad.
- Deshidratación en concentraciones crecientes de etanol y xileno: Posteriormente, las muestras se sometieron a deshidratación gradual en concentraciones crecientes de etanol (50%, 70%, 95% y 100%) y aclaramiento con xileno. De manera análoga al punto anterior, se consideró «apto» si no se producían alteraciones significativas en el medio o en la muestra, y «no apto» en caso contrario.
- Parafinización y corte al microtomo: Las muestras fueron embebidas en parafina para proceder al corte histológico con microtomo (8 μm) y evaluar si su dureza y características permiten un correcto corte con las cuchillas convencionales. Respecto a la parafinización, se consideró «apto» si no se producían alteraciones significativas en la muestra, y «no apto» en caso contrario. En el caso del corte al microtomo, se consideró que la mezcla era «apta» si la sección resultaba limpia y las muestras procesadas no se desestructuraban o dañaban la cuchilla; en caso contrario se consideró como «no apta».
- Estabilidad a 37 ºC: Las muestras fueron mantenidas en estufa a 37 ºC durante al menos 48 horas y posteriormente se evaluó su estado. La estabilidad se determinó en función de la presencia de alteraciones significativas en la muestra, como pérdida del contenido, aglutinamiento, etc. Si no se observó ninguna de estas alteraciones, la muestra se consideró «apta» y, en caso contrario, la muestra se consideró «no apta».
RESULTADOS
En las Imágenes 1, 2 y 3 se muestran los materiales utilizados, disoluciones preparadas y matrices obtenidas. Los valores expresados en cada apartado son la media aritmética de las muestras obtenidas para cada mezcla (entre 5 y 10 muestras por parámetro y mezcla). Los valores de referencia del cartílago articular se han obtenido de la bibliografía (21-24)
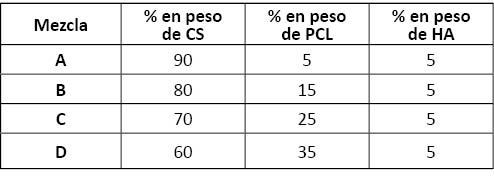
Imagen 1. Materiales utilizados. De izquierda a derecha: CS, PCL, fosfato ácido de diamonio (primera fila), disolución de PCL en glacial, disolución de HA no precipitada, disolución de HA precipitada (segunda fila).
Imagen 2: Quitosano (izquierda) y policaprolactona (derecha) utilizados en los experimentos.
Imagen 3: Muestras de algunas mezclas obtenidas. Pueden observarse los distintos grados de homogeneidad y pH (muestras con rojo fenol).
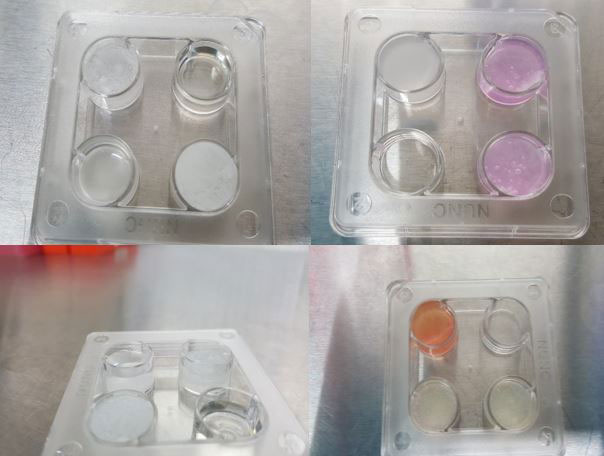
Figura 1: Porcentaje de humedad relativa de las mezclas ensayadas y del cartílago articular (74%). Las mezclas A (62%) y B (60%) mostraron unos resultados de humedad más similares que las mezclas C (51%) y D (45%).
1. Humedad relativa de las mezclas
En la figura 1 se recogen los valores medios de las medidas de humedad relativa obtenidas para cada mezcla.
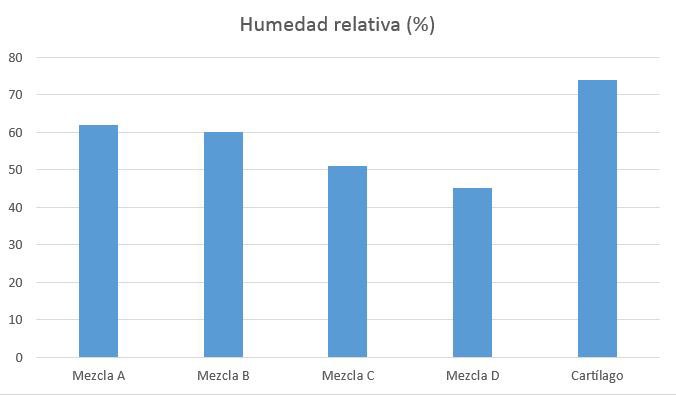
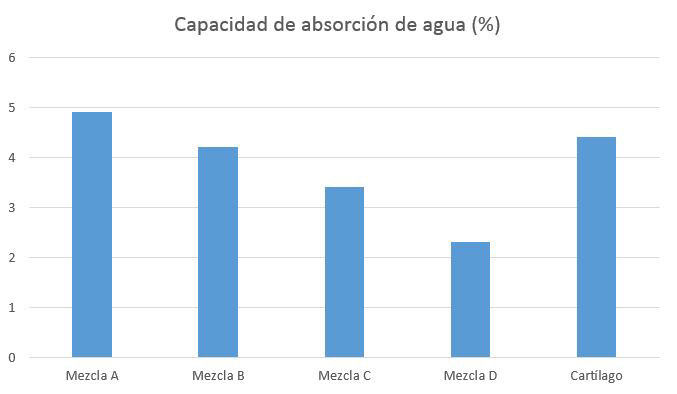
Figura 2: Incremento porcentual de peso de las mezclas para valorar su capacidad de absorción de agua respecto a la del cartílago articular (4,4%). Las mezclas A (4,9%) y B (4,2%) mostraron unos resultados de humedad más similares que las mezclas C (3,4%) y D (2,3%).
2. Capacidad de absorción de agua de las muestras
En la figura 2 se recogen los valores medios de las medidas de absorción de agua obtenidas para cada mezcla.
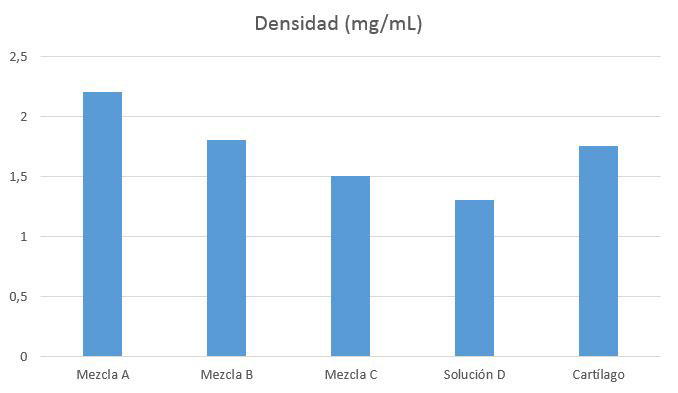
Figura 3: Densidad de las muestras (mg/mL) en comparación con el cartílago humano (0,69). La solución B (0,66) demostró mayor similitud en este parámetro que las soluciones A (0,59), C (0,75) y D (0,78).
3. Densidad de las mezclas
En la figura 3 se recogen los valores medios de las medidas de densidad obtenidas para cada mezcla.
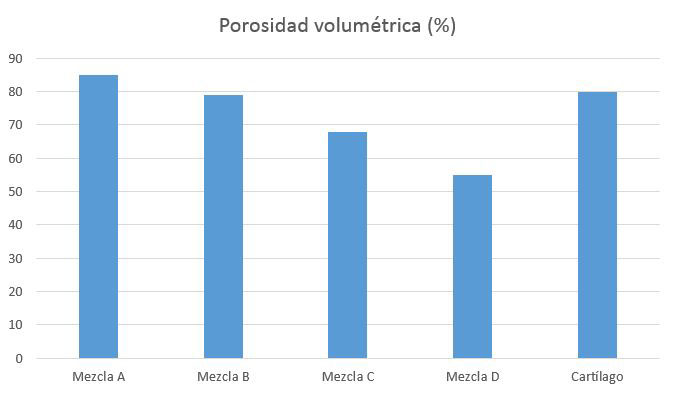
Figura 4: Porosidad volumétrica de las mezclas y del cartílago humano (80%). Las mezclas A (85 %) y B (78 %) mostraron unos resultados más similares al cartílago que las mezclas C (68 %) y D (60 %).
4.Porosidad volumétrica de las mezclas
En la figura 4 se recogen los valores medios de las medidas de porosidad volumétrica obtenidas para cada mezcla.
5. Características de las muestras para procesamiento histológico
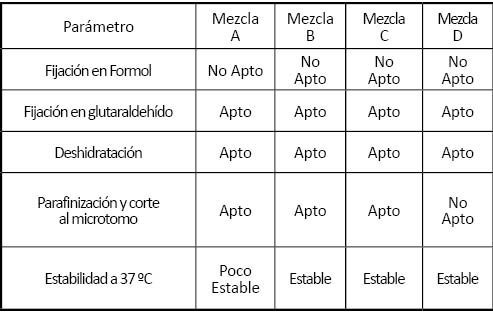
Tabla 2: Evaluación de las mezclas para el procesamiento histológico habitual. La mezcla D fue descartada como posible biomaterial por ser incompatible con las cuchillas de micrótomo convencionales y la solución A por ser inestable a 37ºC.
Imagen 4: fijación de una de las muestras en formaldehido 4% (izquierda) e inclusión de las muestras en parafina para ser seccionadas en el micrótomo (derecha).
En la tabla 2 se recogen los parámetros medidos en el procesamiento histológico para cada mezcla. En la Imagen 4 pueden observarse algunos ejemplos de fijación en formol y parafina.
DISCUSIÓN
En este estudio se presenta una metodología sencilla y económica para generar modelos de cartílago artificial con los que, en un futuro, analizar muchas de las propiedades del cartílago sano y patológico así como crear constructos de cartílago artificial mediante ingeniería tisular. Concretamente, se han obtenido distintas mezclas de CS-PCL-HA y caracterizado varias propiedades biofísicas y de procesamiento que resultan de interés en las mismas.
Los resultados obtenidos en la medición de la humedad relativa muestran que las mezclas A (62%) y B (60%) se acercan más al valor del cartílago articular. Además, existe una relación lineal ostensible entre la humedad relativa y el contenido de CS-PCL, disminuyendo la humedad con el contenido de CS. Este hecho es importante ya que desde hace décadas es conocida la variación del contenido acuoso en relación a determinadas patologías. Por ejemplo, el cartílago de los pacientes con artrosis presenta un contenido acuoso aumentado, y lo mismo ocurre en el caso de derrames, infiltrados y patología inflamatoria (27, 28).También cabe destacar que el contenido en peso de agua varía casi linealmente en función de la distancia hasta la superficie, desde un 85% en la parte más superficial hasta un 70% en la parte más profunda (29). Por todo ello, conocer cómo varía la humedad del constructo en relación al contenido de CS o PCL podría servir para desarrollar modelos de cartílago enfermo o modelos de análisis microfluídico que reproduzcan el transporte de agua y nutrientes en el interior del cartílago.
Respecto a los resultados de la medición de la capacidad para absorber agua, estos concuerdan con los de Xiao et al. (25), quienes encontraron una relación lineal positiva entre el contenido de HA y la capacidad de absorber agua en biomatrices de CS/PCP/HA. En relación a los valores del cartílago articular, las mezclas A y B muestran una mayor similitud respecto al mismo, existiendo, al igual que en el caso anterior, una manifiesta relación lineal decreciente entre el contenido de CS y la capacidad de absorción de agua. Esta propiedad guarda relación con el carácter hidrófilo de la mezcla y podría ser de interés para estudiar procesos de degeneración cartilaginosa, pues permitiría crear modelos tisulares con diferente tasa de absorción de agua para recrear procesos patológicos que tienen lugar en diversas patologías del cartílago articular. Igualmente podrían suponer una ventaja terapéutica para coadyuvar en el tratamiento de defectos cartilaginosos en los que exista un exceso de líquido (inflamación, derrame sinovial), pues podrían obtenerse hidrogeles o matrices hidrófilas con gran capacidad absorbente.
En lo tocante a la densidad y porosidad volumétrica de las mezclas ensayadas, los resultados obtenidos muestran una disminución de ambos valores conforme disminuye el contenido en CS. De forma parecida a lo que ha sucedido en la medición de los parámetros anteriores, las mezclas A y B muestran una mayor similitud respecto a los valores de densidad y porosidad volumétrica del cartílago articular humano. La porosidad guarda una estrecha relación con la permeabilidad del cartílago (30), es decir, con la facilidad para que el líquido fluya a su través, de ahí que, como hemos señalado con anterioridad, sea una variable de gran interés si se desean estudiar los mecanismos de transporte y microfluídica bajo condiciones controladas. Igualmente, la obtención de hidrogeles y matrices que sustituyan el cartílago dañado requiere que no existan grandes diferencias en la densidad del biomaterial utilizado, pues podría generar alteraciones estructurales y funcionales sobre el cartílago regenerado.
En conjunto, de las mezclas de biomateriales (CS, HA y PCL) evaluadas respecto a la humedad relativa, capacidad de absorción de agua, densidad, porosidad volumétrica, las muestras A y B mostraron una mayor similitud con el cartílago humano. Sin embargo, la mezcla A mostraba cierta inestabilidad a 37 ºC y generó algunos problemas en el procesamiento histológico. Por ello parece ser un biomaterial menos apto que la mezcla B, al menos de cara al procesamiento de rutina. Así pues, la mezcla B (80CS/15PCL/5HA) mostró ser similar al cartílago humano en los parámetros medidos y, además, apta para el procesamiento histológico. Cabe destacar el bajo coste de los biomateriales utilizados para su elaboración y la sencillez que muestra para ser manipulados bajo las condiciones habituales del laboratorio y, dada su naturaleza, potencialmente en técnicas actuales como la bioimpresión.
Diversos estudios publicados a lo largo de los últimos años han desarrollado métodos muy diferentes para crear modelos de cartílago artificial. Sin embargo, hasta donde sabemos, la obtención y caracterización de los biomateriales utilizados en este estudio no se ha descrito como modelo de cartílago articular en la literatura científica. Además, cabe destacar que la inclusión de HA permitiría crear un posible modelo de cartílago artificial calcificado sobre el que poder conocer con mayor precisión las enfermedades condrales y ensayar futuras terapias alternativas. Por otro lado, el único tejido artificial comercializado hasta la fecha (Chondrocelect ®) es de cartílago artificial (31), lo que lo convierte en el tejido con mayor proyección terapéutica y posibilidades regenerativas en el futuro inmediato.
Los ventajas de este estudio son la sencillez y el bajo coste económico, además de la optimización de una metodología inicial antes de ensayar la viabilidad celular. Entre las limitaciones del presente trabajo, cabe destacar que hemos podido obtener un biomaterial prometedor, pero aún habrán de aplicársele otros análisis para caracterizarlo por completo, especialmente biomecánicos (estudios de tracción, compresión, reología, etc.) y biológicos (estudios de viabilidad celular).
En suma, la metodología estandarizada en este trabajo permite generar matrices de cartílago artificial con características similares al cartílago humano y capaces de ser sometidas a un procesamiento histológico, hecho muy relevante al que no todos los biomateriales se adaptan, y que acaba generando métodos alternativos de procesamiento que encarecen y dificultan el proceso.
CONCLUSIONES
En este estudio hemos presentado una metodología sencilla y económica de obtener una biomatriz con características de gran interés para emular el cartílago articular en condiciones fisiológicas. Además, se han evaluado varios parámetros (humedad relativa, captación de agua, densidad, porosidad volumétrica y procesamiento histológico) en las combinaciones ensayadas. La mezcla compuesta por quitosano (80%), policaprolactona (15%) e hidroxiapatita (5%) ha resultado, globalmente, la más similar al cartílago articular en los parámetros evaluados en este trabajo. En el futuro será necesario estudiar otras características biomecánicas y biológicas para completar la caracterización de este biomaterial de cara a sus potenciales aplicaciones como modelo tisular de cartílago tanto en condiciones sanas como patológicas.
REFERENCIAS
- Buckwalter JA, Mankin HJ. Articular cartilage: tissue design and chondrocyte-matrix interactions. Instr Course Lect. 1998;47, 477–486.
- Correa D, Lietman SA. Articular cartilage repair: Current needs, methods and research directions. Semin Cell Dev Biol. 2017 Feb;62:67-77.
- Ahmed TA, Hincke MT. Mesenchymal stem cell – based tissue engineering strategies for repair of articular cartilage. Histol Histopathol. 2014;29: 669-689.
- Butler DL, Goldstein SA, Guldberg RE, Mow V, Tranquillo R. The impact of biomechanics in tissue engineering and regenerative medicine. Tissue Engineering, 2009;12:4, 477-484.
- Ross M, Wojcjech P. Tejido cartilaginoso. Histología (5ª edición). Ed. Médica Panamericana 2006;198-208.
- Pathria MN, Chung CB, Resnick DL. Acute and Stress-related Injuries of Bone and Cartilage: Pertinent Anatomy, Basic Biomechanics, and Imaging Perspective. Radiology, 2016;280(1), 21–38.
- Freeman PM, Natarajan RN, Kimura JH, Andriacchi TP. Chondrocyte cells respond mechanically to compressive loads. J Orthop Res 1994;12(3):311–320.
- Seireg A, Arvikar RJ. Prediction of muscular load sharing and joint forces in lower-extremities during walking. J Biomech. 1975;8:89-102.
- Felson DT, Naimark A, Anderson J, Kazis L, Castelli W, Meenan RF. The prevalence of knee osteoarthritis in the elderly. The Framingham Osteoarthritis study. Arthritis Rheum, 1987;30, 914-8.
- Curl WW, Krome J, Gordon ES, Rushing J, Smith BP, Poehling GG. Cartilage injuries: a review of 31,516 knee arthroscopies. Arthroscopy. 1997 Aug;13(4):456-60.
- Hjelle K, Solheim E, Strand T, Muri R, Brittberg M. Articular cartilage defects in 1,000 knee arthroscopies. Arthroscopy. 2002;18(7):730–4.
- Forriol Campos, F. El cartílago articular: aspectos mecánicos y su repercusión en la reparación tisular. Rev Ortop Traumatol 2002;5:380-390.
- Dua R, Comella K, Butler R, Castellanos G, Brazille B, Claude A, et al. Integration of Stem Cell to Chondrocyte-Derived Cartilage Matrix in Healthy and Osteoarthritic States in the Presence of Hydroxyapatite Nanoparticles. PLoS ONE. 2016;11(2):e0149121.
- Benders KEM, Weeren PRv, Badylak SF, Saris DBF, Dhert WJA, Malda J. Extracellular matrix scaffolds for cartilage and bone regeneration. Trends in Biotechnology. 2013;31(3):169–76.
- Ramaswamy S, Uluer MC, Leen S, Bajaj P, Fishbein KW, Spencer RG. Noninvasive assessment of glycosaminoglycan production in injectable tissue-engineered cartilage constructs using magnetic resonance imaging. Tissue engineering Part C, Methods. 2008;14(3):243–9.
- Khanarian NT, Jiang J, Wan LQ, Mow VC, Lu HH. A hydrogel-mineral composite scaffold for osteochondral interface tissue engineering. Tissue engineering Part A. 2012;18(5–6):533–45.
- Dua R, Centeno J, Ramaswamy S. Augmentation of engineered cartilage to bone integration using hydroxyapatite. Journal of biomedical materials research Part B, Applied biomaterials. 2013.
- Sequeda LG, Díaz JM, Gutiérrez SJ, Perdomo SJ, Gómez OL. Obtención de hidroxiapatita sintética por tres métodos diferentes y su caracterización para ser utilizada como sustituto óseo. Rev. Colomb. Cienc. Quím. Farm. 2012;41(1):50-66.
- Liu X, Chen, Y, Huang Q, He W, Feng Q, Yu B. A novel thermo-sensitive hydrogel based on thiolated chitosan/hydroxyapatite/beta-glycerophosphate. Carbohydrate Polymers. 2014;110:62–69.
- Escobar JL. Síntesis, caracterización y aplicaciones biomédicas de redes de copolímeros basados en poliésteres. Tesis doctoral. Valencia (2008). Disponible en: [https://riunet.upv.es/bitstream/handle/10251/3445/tesisUPV2923.pdf]. Consultado el 12 de septiembre de 2016.
- Seifert AC, Wehrli F. Solid-State Quantitative 1H and 31P MRI of Cortical Bone in Humans. Current Osteoporosis Reports, 2016;14(3), 77–86.
- Mow VC, Holmes MH, Michael Lai, W. Fluid transport and mechanical properties of articular cartilage: A review. Journal of Biomechanics, 1984;17(5), 377–394.
- Muir H, Bullough P, Maroudas A. The distribution of collagen in human articular cartilage with some of its physiological implications. J. Bone Jt Surg. 1970;52B:554–563.
- Venn M, Maroudas A. Chemical composition of normal and osteoarthrotic femoral head cartilage. Ann. rheum. Dis. 1977;36:121–129.
- Xiao X, Liu R, Huang Q. Preparation and characterization of nano-hydroxyapatite/polymer composite scaffolds. Journal of Materials Science: Materials in Medicine, 2008; 19(11), 3429–3435.
- Xiao X, Liu R, Huang Q, Ding X. Preparation and characterization of hydroxyapatite/polycaprolactone–chitosan composites. J Mater Sci Mater Med. 2009 Dec;20(12):2375-83.
- Armstrong CG, Mow VC. Friction, lubrication and wear of articular cartilage. In: R. Owen, J.W. Goodfellow, P.G. Bullough (Eds.), Scientific Foundations of Orthopaedics and Traumatology, William Heinemann, London 1980;223–232.
- Maroudas A. Physicochemical properties of articular cartilage. In: M.A.R. Freeman (Ed.), Adult Articular Cartilage, Pitman Medical, Kent, U.K 1979;215–290.
- Lipshitz H, Etheridge R, Glimcher MJ. Changes in hexosamine content and swelling ratio of articular cartilage as a function of depth from the surface. J. Bone Jt Surg. 1976;58A;1149–1153.
- Mansour J, Mow CV. The permeability of articular cartilage under compressive strain and at high pressures. J. Bone Jt Surg., 1976;58A:509–516.
- Gerlier L, Lamotte M, Wille M, Kreuz PC, Vanlauwe J, Dubois D, et al. The cost utility of autologous chondrocytes implantation using ChondroCelect® in symptomatic cartilage lesions in Belgium. Pharmacoeconomics. 2010;28(12):1129-46.
INFORMACIÓN DEL ARTÍCULO
Agradecimientos: El presente estudio se ha realizado en el marco del trabajo de fin de grado del autor principal. Agradecemos profundamente el trato y la ayuda prestada por los miembros del departamento de Histología de la facultad de Medicina de Granada.
Conflicto de Intereses: Los autores declaran no tener ningún conflicto de intereses.
Autor para la correspondencia: Antonio Jesús Láinez Ramos. E-mail: jbossini@correo.ugr.es