Revisión
Nuevos retos de la fabricación de mucosa oral mediante técnicas de Ingeniería Tisular
New challenges on the production of oral mucosa using Tissue Engineering Techniques
Actual. Med. 2016; 101: (799): 176-182 DOI: 10.15568/am.2016.799.re01
Enviado: 17-09-2016
Revisado: 30-10-2016
Aceptado: 26-12-2016
RESUMEN
En los últimos años, la fabricación de tejidos artificiales mediante técnicas de Ingeniería Tisular ha sido de gran interés en el área de las ciencias de la salud. En concreto, en el campo odontológico y maxilofacial, la fabricación de una mucosa oral artificial completamente funcional ha sido un reto constante para la Ingeniería Tisular. En este sentido, aunque se han desarrollado diversos modelos de mucosa oral humana, aún existen carencias en lo que se refiere al mimetismo de los tejidos artificiales y los tejidos orales nativos. Dentro de dichas carencias destacan los tiempos prolongados del cultivo de queratinocitos, su baja capacidad de proliferación, la obtención de epitelios delgados y sin crestas epiteliales, la falta de vascularización en la zona implantada y la obtención de tejidos con una unión muco-cutánea para la reconstrucción del labio. El objetivo de esta revisión es mostrar los avances que hasta el momento se han obtenido en materia de la Ingeniería Tisular de la mucosa oral, así como discutir los retos por superar y sus posibles soluciones.
Palabras clave: Mucosa oral, Ingeniería Tisular, Andamios, Células madre.
ABSTRACT
In recent years, the production of artificial tissues by Tissue Engineering techniques has been of great interest in the health sciences area. Specifically, in the dental and maxillofacial field. In this context, to develop a fully functional artificial oral mucosa is a constant challenge for Tissue Engineering. In this regard, several human oral mucosa models have been developed. However, prolonged periods of keratinocyte culture, low proliferation capacity, absence of rete ridges, and the lack of vascularization are the major shortcomings in this area. The objective of this review is to show the progress that so far have been obtained in the field of Tissue Engineering of the oral mucosa, as well as discuss the challenges ahead and possible solutions.
Keywords: oral mucosa, Tissue Engineering, scaffold, stem cells.
Leer Artículo Completo
INTRODUCCIÓN
A pesar de que se han logrado grandes avances en la Ingeniería Tisular (IT) de la mucosa oral, hasta el momento no ha sido posible elaborar una mucosa oral generada por Ingeniería Tisular (MOIT) con todas las características funcionales propias de la mucosa oral humana, con un epitelio organizado, bien diferenciado y con una adecuada vascularización. En este contexto, se han detectado diferentes problemas en torno a la producción de una mucosa oral artificial, como por ejemplo los largos tiempos de cultivo para obtener queratinocitos, la baja capacidad de proliferación de las células epiteliales, la obtención de epitelios delgados y sin formación de crestas epiteliales, la falta de vascularización que conlleva al fracaso del implante y la obtención de tejidos con una unión muco-cutánea para ser empleados en la reconstrucción del labio. El objetivo de esta revisión es mostrar los avances que hasta el momento se han obtenido en materia de la Ingeniería Tisular de la mucosa oral, así como discutir los retos por superar y sus posibles soluciones. Para ello se ha llevado a cabo una revisión bibliográfica en PubMed y en las distintas revistas de impacto en Odontología, desde el año 2006 a 2016.
La Ingeniería Tisular es una ciencia multidisciplinaria cuyo objetivo es el desarrollo de estrategias para la generación de órganos y tejidos completamente funcionales; estrategias que se basan en la interacción de tres componentes fundamentales como son: células, factores de crecimiento y andamios (1).
Visto de esta forma, las células son la unidad básica de los tejidos y en la IT de la mucosa oral se han utilizado diferentes fuentes celulares para generar MOITs como por ejemplo queratinocitos y fibroblastos orales (2)(3), células madre de la gelatina de Wharton del cordón umbilical humano (HWJSCs) (4), queratinocitos del cordón umbilical (5), células endoteliales (6) etc.
Por otra parte, los factores de crecimiento son moléculas que desempeñan un papel fundamental en el crecimiento y actividad de las células, siendo capaces de desencadenar señales intracelulares con influencia en la diferenciación, proliferación y migración celular, y por tanto interviniendo en su comportamiento y actividad (7). En la IT de la mucosa oral, se han utilizado diferentes factores de crecimiento como el factor de crecimiento epidermal (EGF), factor de crecimiento de queratinocitos (KGF), factor de crecimiento fibroblástico (FGF), albúmina de suero bobino (BSA), hidrocortisona, adenina, insulina, transferrina, triyodotironina, CaCl2, entre otros.
Por último, la función de un andamio es servir como soporte estructural y guía para la formación del nuevo tejido, proporcionando un ambiente en tres dimensiones que facilite la adherencia, migración, proliferación y organización espacial tridimensional de las células (8). Un andamio constituye un soporte físico, que tiene un papel determinante en el crecimiento y diferenciación celular y por tanto en la función del tejido (8). En la IT de la mucosa oral, se han utilizado diferentes andamios: dermis cadavérica acelular (9), sustitutos dérmicos (10)(2), colágeno (6), fibrina (11), también se han probado andamios compuestos de combinaciones de polímeros (12)(4)(13) e incluso polímeros recombinantes (14).
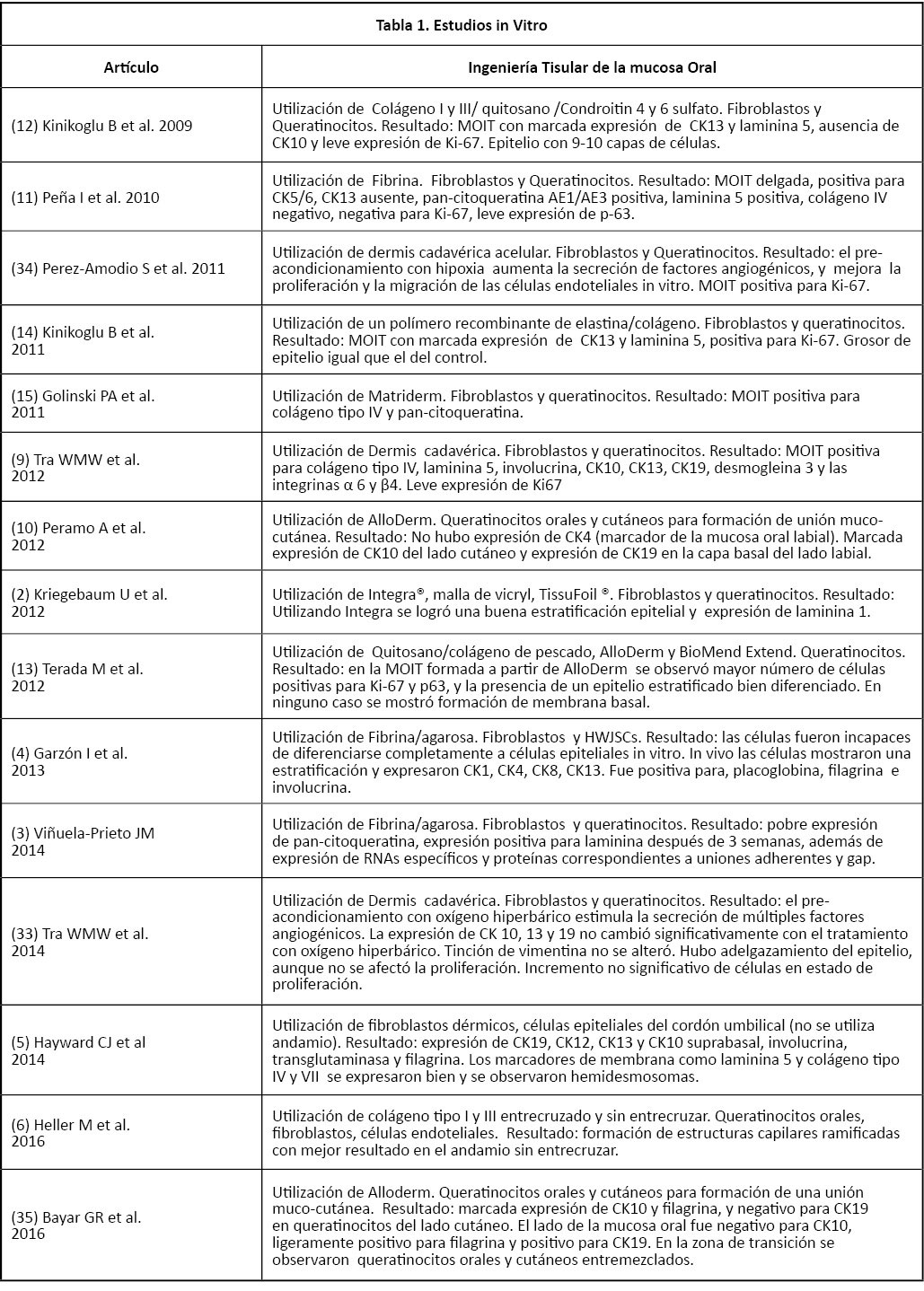
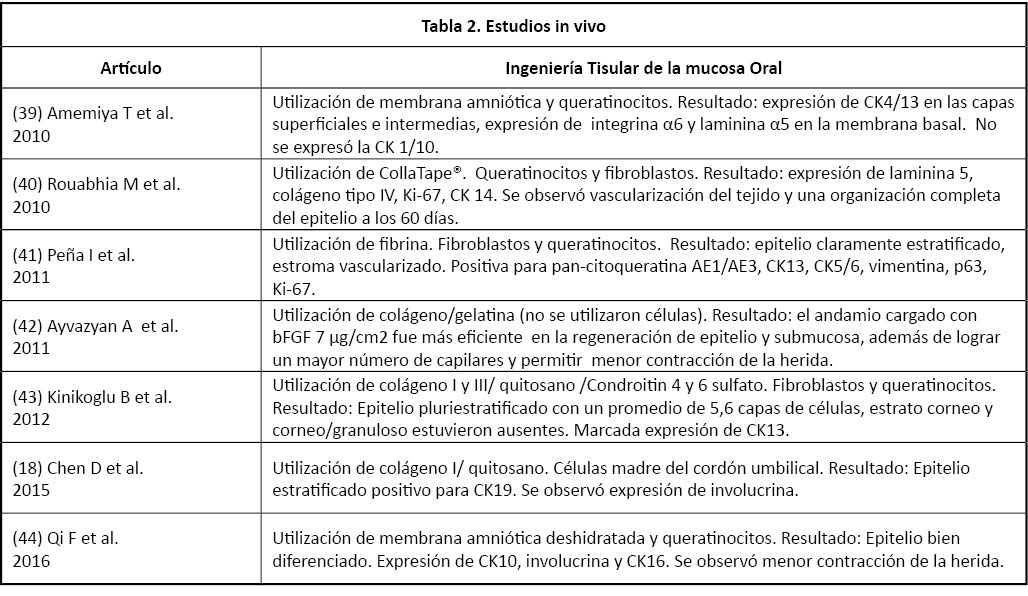
En las tablas 1 y 2 se muestra un resumen de los últimos estudios in vitro e in vivo, en donde se precisa el andamio utilizado, la fuente celular, los factores de crecimiento, objetivos del estudio y resultados.
Tabla 1. Estudios in Vitro
Tabla 2. Estudios in vivo
RETOS DE LA INGENIERÍA TISULAR DE LA MUCOSA ORAL
En el camino hacia el objetivo de generar una mucosa oral artificial con las características funcionales propias de la mucosa oral humana, se han identificado diferentes retos por superar, los cuales serán analizados a continuación.
Cultivo de queratinocitos.
En el proceso de traslación clínica de la mucosa oral generada por Ingeniería tisular es de gran importancia la reducción de los tiempos de cultivo y la obtención de un número considerable de células epiteliales. En este sentido, las células epiteliales de la mucosa oral (queratinocitos) cultivadas in vitro tienden a tener un tiempo de proliferación y crecimiento prolongado, de aproximadamente 25 días (2); sumado a ello, es necesario tener en cuenta el tiempo mínimo de fabricación in vitro de la MOIT antes de ser implantada, que puede variar de tres (3) a cuatro semanas (11)(15) según el método de cultivo empleado.
Actualmente existen dos métodos para cultivar queratinocitos, el primero planteado por Rheinwald y Green (16), que se basa en la utilización de capas alimentadoras de fibroblastos murinos irradiados que contribuyen a la expansión de las células epiteliales al proporcionarles factores de crecimiento. El segundo método se basa en la utilización de medios de cultivo especialmente suplementados con todos los factores de crecimiento esenciales para la expansión de queratinocitos, evitando así la necesidad de utilizar una capa alimentadora, la cual ha sido muy cuestionada debido a la posibilidad de trasmisión de enfermedades y mayor probabilidad de rechazo del implante (17). La utilización de medios de cultivo previene los problemas que se puedan presentar con el primer método, pues si bien algunos medios contienen extracto pituitario bovino, ciertos estudios han eliminado éste componente para evitar cualquier riesgo de contaminación o trasmisión de enfermedades por animales (13). Recientemente, diversas investigaciones han optado por utilizar técnicas de separación de células epiteliales mediante la técnica de explantes sin la necesidad de utilizar capa alimentadora de células y con la utilización de factores de crecimiento como el EGF (4)(6)(13).
Otro de los problemas detectados en el cultivo de queratinocitos es la dificultad para obtener grandes cantidades de epitelio, cuya solución podría ser la utilización de células madre como fuente alternativa (4)(18), ya que con fuentes de células madre como las del cordón umbilical se evitaría la obtención de tejido del paciente, lo cual implica ausencia de morbilidad de la zona donante. De ésta forma también se superaría la limitación que existe para obtener grandes cantidades de queratinocitos para cubrir heridas extensas. Otra fuente de células madre que podría ser tenida en cuenta son las células madre de la pulpa dental, cuya obtención no es invasiva y son células con alta capacidad de proliferación y auto-renovación comparadas con otras células madre mesenquimales adultas, que podrían ser capaces de diferenciarse a queratinocitos (19).
Además de células madre de la gelatina de Wharton (4), se han utilizado diferentes fuentes de células madre para su diferenciación a células epiteliales, como por ejemplo las células madre de la médula ósea (20)(21), células madre del folículo piloso (22), células madre del estroma corneal (23), células madre embrionarias (24), células madre de la pulpa dental (25), células madre adiposas (26), las cuales también se podrían proponer para ser utilizadas en la generación de epitelio de la mucosa oral.
Baja capacidad de proliferación de las células epiteliales.
Kinikoglu B et al; en estudios realizados en 2009 reportó resultados poco satisfactorios relacionados con la baja capacidad de proliferación de las células epiteliales en una MOIT obtenida a partir de un andamio de colágeno/quitosano/condroitín sulfato in vitro (12). Sin embargo, en 2011 Kinikoglu et al; logra obtener una MOIT con un número de células en estado proliferativo tan alto como el de la mucosa oral control (14). Consigue estos resultados utilizando un andamio compuesto de un polímero recombinante de elastina/colágeno con la secuencia de adhesión celular RGD (arginina- glicina-ácido aspártico), y utilizando exactamente el mismo protocolo de elaboración de la MOIT que utilizó en 2009, con la única excepción de haber utilizado éste nuevo andamio. El empleo de este andamio pudo haber favorecido la adhesión inicial de células madre epiteliales, además de haber incrementado la proliferación celular gracias a que la secuencia RGD es un motivo del factor de crecimiento epidermal (14). Por lo anteriormente descrito, se podría pensar que a la hora de generar una MOIT con presencia de células basales en estado proliferativo podría influir el tipo de andamio utilizado.
Por otra parte, las células madre adultas que residen en los diferentes tejidos, son las responsables de su mantenimiento y reparación, esto gracias al dinamismo que existe con su nicho, que es el encargado de recibir y trasmitir mensajes desde la periferia ante la presencia de un evento de tipo patológico o al someter al tejido a stress, para así iniciar el proceso de reparación con la ayuda de complejas vías de señalización (27). Con relación a la capacidad de proliferación de las mucosas orales obtenidas a partir de Ingeniería Tisular, estudios han mostrado una reducción en el número de células en estado de proliferación al finalizar el periodo de cultivo (12) e incluso la ausencia de éstas células (11). Con base en lo expuesto, se ha planteado la utilización de células madre capaces de autorenovarse con el fin de generar epitelio y así dar solución al problema de la baja capacidad de proliferación de las células epiteliales en las MOITs (4)(18). Garzón I et al; demostró que las células de la gelatina de Wharton son capaces de diferenciarse eficientemente a linajes celulares ectodérmicos con altos niveles de maduración in vivo. Los análisis revelaron la formación de unas capas basal, espinosa, granulosa y cornea bien definidas, especialmente después de 20 días in vivo. Además, la MOIT mostró varias uniones intercelulares similares al control pasados 30 días del implante (4).
Epitelios delgados y sin crestas epiteliales.
Es usual encontrar que las mucosas orales generadas a partir de Ingeniería Tisular cuenten con epitelios delgados. En este hecho podría influir el rol esencial de los fibroblastos del estroma, basado en la producción de los componentes de la membrana basal, la cual es fundamental en la maduración y estratificación epitelial (27). Los fibroblastos promueven el desarrollo de las capas de queratinocitos del epitelio, además de influir en su proliferación (15), por lo cual es crucial que a la hora de construir una MOIT se cuente con un buen soporte estromal que promueva la formación de una membrana basal y por tanto la formación de capas epiteliales bien organizadas. Por otra parte, se ha demostrado que el origen de la fuente de células mesénquimales utilizada para generar estromas o tejidos conectivos de una MOIT tiene una influencia significativa sobre el espesor y la ultraestructura del epitelio oral, pero no sobre su proceso de diferenciación, el cual podría ser una propiedad intrínseca de estas células debida a su reprogramación genética (28). Así, la interacción con fibroblastos orales resulta en un epitelio más grueso en comparación con la interacción con fibroblastos obtenidos de otras fuentes como dermis o cornea (28).
Recientemente se encontró que el empleo de 2 o 10 mM de XPP (β-D-xylopyranosiden-propane-2-one) durante la elaboración de una MOIT podría aumentar el espesor promedio del epitelio sin afectar la estructura epitelial o su proceso de diferenciación, y estimular la expresión de decorina, sindecano-1, integrina α6, CD44, y los sustratos de señalización Akt/mTOR importantes en el crecimiento celular, síntesis de proteínas y espesor epitelial (29).
Además de esto, es frecuente encontrar epitelios en ausencia de crestas epiteliales, las cuales tienen dos funciones principales como son proveer una fuerza de enclavamiento para mejorar la conexión entre el epitelio y la lámina propia, y albergar los nichos de células madre epiteliales, por lo que sin ellas el epitelio de las MOIT se separa fácilmente (30). Xiong et al; sugirió que las crestas epiteliales no son formaciones congénitas sino que éstas se forman paralelamente con el desarrollo general del organismo, y son producto de fuerzas mecánicas, las cuales desencadenan diferentes cascadas de señalización (ERK1/2, p38 y JNK) en los queratinocitos, lo que los estimula a dividirse (31). Las fuerzas mecánicas también estimulan a las metaloproteinasas de matriz, las cuales liberan factores de crecimiento que influyen en la proliferación de los queratinocitos y además degradan la matriz extracelular para favorecer la migración de estas células. La longitud de las crestas epiteliales posiblemente se relaciona con la fuerza de las tensiones mecánicas, pues las crestas epiteliales de la mucosa masticatoria son más largas que las de la mucosa de revestimiento (31). Tianfu Wu et al; sugirió dos métodos para inducir la formación de crestas epiteliales en una MOIT, uno es añadir activadores de ERK1/2 como EGF, ácido araquidónico, estrógeno etc; y el otro sería la sobreexpresión del activador ERK1/2 mediante un portador molecular inofensivo e intercambiable (30).
Vascularización.
Circunstancias que pueden ocurrir en las MOIT implantadas como la falta de vascularización o una revascularización lenta, podrían conducir al fracaso del implante, que evidentemente conlleva a necrosis del tejido (32). La revascularización de los constructos tridimensionales después del implante es determinante ya que el oxígeno es un componente crítico en el proceso de curación de las heridas estando involucrado en la re-epitelización, síntesis de colágeno, angiogénesis, y muerte oxidativa de bacterias, nutre a las células epiteliales y es necesario para mantener la supervivencia a largo plazo de las MOITs (32)(33). Con el fin de superar este problema, se han desarrollado diferentes estrategias para promover la formación de vasos sanguíneos como: la aplicación directa de células endoteliales dentro del biomaterial, la adición de factores de crecimiento en el biomaterial y la inyección directa de células endoteliales en el sitio del implante, además de otros (6). Sin embargo, hasta el momento no se ha alcanzado una solución satisfactoria. También se ha planteado que un pre-acondicionamiento de las MOITs en condiciones de hipoxia (34) o con oxígeno hiperbárico (33) podría estimular la secreción de múltiples factores angiogénicos y mejorar la proliferación y migración endotelial.
Recientemente Heller et al; logró conseguir una buena vascularización en una MOIT generada a partir de andamios de colágeno tipo I y III, sin entrecruzamiento (6). Para ello se cultivaron células endoteliales sobre el andamio incubándolas durante un día, después del cual se cultivaron fibroblastos en la parte superior de éstas células. Después de 3 días se cultivaron células epiteliales en el lado contrario del andamio por 3 semanas más. Al finalizar el periodo de cultivo se encontró formación de estructuras capilares ramificadas con un mejor resultado cuando se utilizó una concentración de células endoteliales y fibroblastos de 4 x 10 (5) células/cm (2) cada una. Mientras que las células endoteliales formaron una densa red de estructuras similares a capilares en el andamio sin entrecruzar, solamente se encontró una pobre formación de estas estructuras cuando el andamio se entrecruzó. Aunque la secreción celular de VEGF (factor de crecimiento endotelial vascular) fue menor en los cultivos con andamios sin entrecruzar, los demás factores angiogénicos investigados (PDGF, angiopoyetina e IL-8) mostraron niveles más altos cuando se compararon con el andamio entrecruzado. Cuando se probó la integración in vivo del andamio sin entrecruzar, se mostró biocompatible, los experimentos in vivo no revelaron ningún tipo de complicación asociada a la intervención quirúrgica del proceso de implantación. El análisis histológico mostró vasos sanguíneos dentro de la MOIT y eritrocitos dentro de éstos vasos, probando que las estructuras capilares pre-formadas formaron vasos sanguíneos funcionales in vivo.
Uniones Muco-cutáneas y reconstrucción labial.
Se ha planteado la necesidad de crear sustitutos de piel y mucosa oral con una unión muco-cutánea con la que se pueda reconstruir los defectos del labio. Para ello Peramo et al; desarrolló una técnica en donde logró que células epiteliales cutáneas y orales sembradas sobre un andamio de AlloDerm migraran y se encontraran para así conformar ésta estructura (10). El análisis de los tejidos obtenidos no mostró expresión de citoqueratina (CK) 4 (marcador de la mucosa labial), pero si mostró una marcada expresión de CK 10 del lado cutáneo y de CK 19 solamente en la capa basal del lado labial. En términos generales, la técnica desarrollada en éste estudio es una base para futuras investigaciones, que aunque debe ser refinada, representa una alternativa importante para la Ingeniería Tisular de las uniones muco-cutáneas y reconstrucción labial. Recientemente Bayar et al; utilizó un dispositivo de cultivo celular elaborado con silicona, con el fin de mejorar el método de elaboración de tejidos con unión muco-cutánea (35). La ventaja de ésta técnica sobre la de Peramo et al; podría ser el control que se logra sobre la forma y tamaño de los constructos, pues el dispositivo se puede elaborar con la forma de conveniencia según el defecto a reparar.
Los anteriores experimentos no utilizaron fibroblastos para proporcionar un soporte estromal adecuado, por lo que sería interesante lograr un constructo completo cuyo estroma pueda influir en el mejoramiento de la estratificación y grosor epitelial como antes se explicó.
Estudios clínicos.
En la práctica odontológica o médica aún no es posible utilizar MOITs para el tratamiento de pacientes, sin embargo, se han hecho algunos estudios que han demostrado resultados clínicos prometedores.
Peña et al; aplicó un tratamiento en 4 pacientes que requerían reconstrucción de mucosa oral con MOITs obtenidas mediante queratinocitos, fibroblastos y un andamio de fibrina autóloga (36). A pesar de haber utilizado una capa alimentadora murina, no se observaron complicaciones post-implante y después de un mes se evidenció una buena integración al tejido, siendo difícil diferenciar el área injertada de los tejidos adyacentes. Sin embargo, en éste ensayo no se realizó un estudio histológico post-implante, por lo cual no fue posible evaluar la calidad del tejido logrado y tampoco cómo influyó el hecho de haber cultivado la MOIT en condiciones de inmersión con respecto a la maduración del epitelio pos-implante. A pesar de haber obtenido buenos resultados clínicos es importante seguir estudiando ésta técnica y confirmar histológicamente la integridad y funcionalidad del epitelio, así como la inocuidad de la técnica por el uso de capa alimentadora murina, que tal vez podría ser reemplazada por medios de cultivo enriquecidos.
Asimismo, Izumi et al; demostró la seguridad y eficacia clínica de una MOIT obtenida a partir de un andamio de AlloDerm y queratinocitos orales autólogos, la cual fue implantada en 5 pacientes con necesidad de cirugía para aumentar el ancho de la mucosa oral queratinizada (37). Durante el estudio no se observaron complicaciones o reacciones adversas y se obtuvo un promedio de ganancia de encía queratinizada de 3mm, no se observaron cambios significativos en la profundidad del sondaje. Clínicamente la MOIT generada fue fácil de manipular y proporcionó un implante gingival con una buena apariencia estética por su color y espesor. Esta técnica es una buena opción de tratamiento para aumentar la profundidad del surco vestibular, sin embargo, es necesario realizar más estudios que proporcionen evidencia histológica sobre la calidad del tejido post-implante. La ventaja de utilizar sustitutos dérmicos como el AlloDerm para generar mucosa oral es la facilidad de consecución de éste andamio.
CONCLUSIÓN
Para llegar a utilizar clínicamente una MOIT es necesario reducir los tiempos de obtención de los tejidos artificiales de mucosa oral, además de encontrar fuentes alternativas a los queratinocitos orales. Para ello, es importante tener en cuenta la capacidad de diferenciación epitelial de las células madre de la gelatina de Wharton y las células madre de la pulpa dental, cuya obtención es mínimamente invasiva y cuentan con una alta capacidad de proliferación y auto-renovación, además de que se pueden obtener cantidades considerables de ellas. Por otra parte es necesario tener en cuenta que tanto el tipo de andamio como la utilización de células madre en la generación de las MOITs pueden influir en la capacidad de proliferación de las células epiteliales.
Para generar una MOIT con un epitelio de buen espesor y estratificación es esencial el rol que cumple la utilización de un buen soporte estromal, el cual debe ser elaborado preferiblemente con fibroblastos orales y no con fibroblastos de otras fuentes celulares ya que la interacción con fibroblastos orales resulta en un epitelio más grueso en comparación con la interacción con fibroblastos obtenidos de otras fuentes como dermis o córnea. Adicionalmente la utilización de algunas moléculas como la XPP (β-D-xylopyranosiden-propane-2-one) para suplementar los medios de cultivo podría contribuir a mejorar el espesor epitelial.
Por otra parte, las crestas epiteliales son producto de fuerzas mecánicas que influyen en la proliferación de los queratinocitos y en la degradación de la matriz extracelular para favorecer la migración de las células, proceso que se lleva a cabo paralelamente con el desarrollo general del organismo. Para inducir la formación de crestas epiteliales en una MOIT se ha propuesto añadir activadores de la cascada de señalización ERK1/2 o la sobreexpresión de activador ERK1/2.
Otro de los grandes retos de la IT de la mucosa oral que hace falta por superar es lograr un tejido vascularizado. En este sentido, para mejorar la vascularización de la zona implantada se podría recurrir al pre-acondicionamiento de las MOITs en condiciones de hipoxia o con oxígeno hiperbárico. No obstante con la utilización ingeniosa de las células (incluidas células endoteliales), factores de crecimiento y un andamio adecuado es posible generar una MOIT vascularizada con una supervivencia a largo plazo.
Son pocos los estudios que hasta el momento se han realizado con el objetivo de obtener tejidos con una unión muco-cutánea para ser usados en la reconstrucción del labio, y aunque hace falta perfeccionar la técnica de elaboración se visualiza un futuro prometedor.
Finalmente, a pesar de que clínicamente se obtengan buenos resultados sobre una MOIT, es necesario tener en cuenta que el objetivo de la Ingeniería Tisular es generar tejidos funcionales similares a los tejidos naturales, por lo cual, es importante que los resultados clínicos sean confrontados con los resultados histológicos de tal forma que se pueda corroborar esta funcionalidad.
Todavía es largo el camino por recorrer para lograr un tejido completo y funcional que pueda ser generado en poco tiempo y con la extensión necesaria para cubrir los posibles defectos de la mucosa oral. Los retos detectados durante el trayecto deberán ser superados para así obtener una mucosa oral ideal que pueda ser implementada clínicamente de forma satisfactoria.
REFERENCIAS
- Nerem RM, Sambanis A. Tissue engineering: from biology to biological substitutes. Tissue Eng [Internet]. 1995 [cited 2016 Aug 25];1(1):3–13. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19877911
- Kriegebaum U, Mildenberger M, Mueller-Richter UDA, Klammert U, Kuebler AC, Reuther T. Tissue engineering of human oral mucosa on different scaffolds: In vitro experiments as a basis for clinical applications. Oral Surg Oral Med Oral Pathol Oral Radiol [Internet]. Elsevier; 2012;114(SUPPL. 5):S190–8. Available from: http://dx.doi.org/10.1016/j.oooo.2011.10.019
- Viñuela-Prieto JM, Sánchez-Quevedo MC, Alfonso-Rodríguez CA, Oliveira AC, Scionti G, Martín-Piedra MA, et al. Sequential keratinocytic differentiation and maturation in a three-dimensional model of human artificial oral mucosa. J Periodontal Res [Internet]. 2014 Oct [cited 2016 Jun 23];50(5):658–65. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25470318
- Garzón I, Miyake J, González-Andrades M, Carmona R, Carda C, Sánchez-Quevedo M del C, et al. Wharton’s jelly stem cells: a novel cell source for oral mucosa and skin epithelia regeneration. Stem Cells Transl Med [Internet]. 2013;2(8):625–32. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3726142&tool=pmcentrez&rendertype=abstract
- Hayward CJ, Fradette J, Morissette Martin P, Guignard R, Germain L, Auger FA. Using human umbilical cord cells for tissue engineering: A comparison with skin cells. Differentiation. 2014;87(3):172–81.
- Heller M, Frerick-Ochs E V, Bauer H-K, Schiegnitz E, Flesch D, Brieger J, et al. Tissue engineered pre-vascularized buccal mucosa equivalents utilizing a primary triculture of epithelial cells, endothelial cells and fibroblasts. Biomaterials [Internet]. 2016 Jan [cited 2016 Jun 18];77:207–15. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26606446
- Lee K, Silva EA, Mooney DJ. Growth factor delivery-based tissue engineering: general approaches and a review of recent developments. J R Soc Interface [Internet]. The Royal Society; 2011 Feb 6 [cited 2016 Aug 24];8(55):153–70. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20719768
- O’Brien FJ. Biomaterials & scaffolds for tissue engineering. Mater Today. 2011;14(3):88–95.
- Tra WMW, van Neck JW, Hovius SER, van Osch GJVM, Perez-Amodio S. Characterization of a three-dimensional mucosal equivalent: similarities and differences with native oral mucosa. Cells Tissues Organs [Internet]. 2012 [cited 2016 Jun 17];195(3):185–96. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21494020
- Peramo A, Marcelo CL, Feinberg SE. Tissue engineering of lips and muco-cutaneous junctions: in vitro development of tissue engineered constructs of oral mucosa and skin for lip reconstruction. Tissue Eng Part C Methods [Internet]. 2012 Apr [cited 2016 Jun 17];18(4):273–82. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22067042
- Peña I, Junquera LM, Meana A, García E, García V, De Vicente JC. In vitro engineering of complete autologous oral mucosa equivalents: characterization of a novel scaffold. J Periodontal Res [Internet]. 2010 Jun [cited 2016 Jun 17];45(3):375–80. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20337894
- Kinikoglu B, Auxenfans C, Pierrillas P, Justin V, Breton P, Burillon C, et al. Reconstruction of a full-thickness collagen-based human oral mucosal equivalent. Biomaterials [Internet]. 2009 Nov [cited 2016 Jun 17];30(32):6418–25. Available from: http://www.ncbi.nlm.nih.gov/pubmed/19698987
- Terada M, Izumi K, Ohnuki H, Saito T, Kato H, Yamamoto M, et al. Construction and characterization of a tissue-engineered oral mucosa equivalent based on a chitosan-fish scale collagen composite. J Biomed Mater Res B Appl Biomater [Internet]. 2012 Oct [cited 2016 Jun 23];100(7):1792–802. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22807349
- Kinikoglu B, Rodríguez-Cabello JC, Damour O, Hasirci V. The influence of elastin-like recombinant polymer on the self-renewing potential of a 3D tissue equivalent derived from human lamina propria fibroblasts and oral epithelial cells. Biomaterials [Internet]. 2011 Sep [cited 2016 Jun 17];32(25):5756–64. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21592566
- Golinski PA, Gröger S, Herrmann JM, Bernd A, Meyle J. Oral mucosa model based on a collagen-elastin matrix. J Periodontal Res [Internet]. 2011 Dec [cited 2016 Jul 4];46(6):704–11. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21781121
- Rheinwald JG, Green H. Serial cultivation of strains of human epidermal keratinocytes: the formation of keratinizing colonies from single cells. Cell [Internet]. 1975 Nov [cited 2016 Jul 5];6(3):331–43. Available from: http://www.ncbi.nlm.nih.gov/pubmed/1052771
- Dickhuth J, Koerdt S, Kriegebaum U, Linz C, Müller-Richter UD, Ristow O, et al. In vitro study on proliferation kinetics of oral mucosal keratinocytes. Oral Surg Oral Med Oral Pathol Oral Radiol. 2015;120(4):429–35.
- Chen D, Hao H, Tong C, Liu J, Dong L, Ti D, et al. Transdifferentiation of Umbilical Cord-Derived Mesenchymal Stem Cells Into Epidermal-Like Cells by the Mimicking Skin Microenvironment. Int J Low Extrem Wounds [Internet]. 2015;14(2):136–45. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25700709
- Garzón I, Martin-Piedra MA, Alaminos M. Human dental pulp stem cells. A promising epithelial-like cell source. Med Hypotheses. 2015;84(5):516–7.
- Liu Y, Wang X, Jin Y. Can bone marrow cells give rise to cornea epithelial cells? Med Hypotheses. 2008;71(3):411–3.
- Laco F, Kun M, Weber HJ, Ramakrishna S, Chan CK. The dose effect of human bone marrow-derived mesenchymal stem cells on epidermal development in organotypic co-culture. J Dermatol Sci. 2009;55(3):150–60.
- Meyer-Blazejewska EA, Call MK, Yamanaka O, Liu H, Schlötzer-Schrehardt U, Kruse FE, et al. From hair to cornea: Toward the therapeutic use of hair follicle-derived stem cells in the treatment of limbal stem cell deficiency. Stem Cells. 2011;29(1):57–66.
- Hashmani K, Branch MJ, Sidney LE, Dhillon PS, Verma M, McIntosh OD, et al. Characterization of corneal stromal stem cells with the potential for epithelial transdifferentiation. Stem Cell Res Ther [Internet]. 2013;4(3):75. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=4058700&tool=pmcentrez&rendertype=abstract
- Ahmad S, Stewart R, Yung S, Kolli S, Armstrong L, Stojkovic M, et al. Differentiation of human embryonic stem cells into corneal epithelial-like cells by in vitro replication of the corneal epithelial stem cell niche. Stem Cells. 2007;25(5):1145–55.
- Gomes JÁP, Monteiro BG, Melo GB, Smith RL, da Silva MCP, Lizier NF, et al. Corneal reconstruction with tissue-engineered cell sheets composed of human immature dental pulp stem cells. Investig Ophthalmol Vis Sci. 2010;51(3):1408–14.
- Chavez-Munoz C, Nguyen KT, Xu W, Hong SJ, Mustoe TA, Galiano RD. Transdifferentiation of adipose-derived stem cells into keratinocyte-like cells: Engineering a stratified epidermis. PLoS One. 2013;8(12).
- Ferraro F, Celso C Lo, Scadden D. Adult stem cels and their niches. Adv Exp Med Biol [Internet]. NIH Public Access; 2010 [cited 2016 Jul 5];695:155–68. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21222205
- Kinikoglu B, Rovere MR, Haftek M, Hasirci V, Damour O. Influence of the mesenchymal cell source on oral epithelial development. J Tissue Eng Regen Med [Internet]. 2012 Mar [cited 2016 Aug 7];6(3):245–52. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21548135
- Uenoyama A, Kakizaki I, Shiomi A, Saito N, Hara Y, Saito T, et al. Effects of C-xylopyranoside derivative on epithelial regeneration in an in vitro 3D oral mucosa model. Biosci Biotechnol Biochem [Internet]. 2016 Jul [cited 2016 Aug 7];80(7):1344–55. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26966997
- Wu T, Xiong X, Zhang W, Zou H, Xie H, He S. Morphogenesis of rete ridges in human oral mucosa: a pioneering morphological and immunohistochemical study. Cells Tissues Organs [Internet]. 2013 [cited 2016 Jul 9];197(3):239–48. Available from: http://www.ncbi.nlm.nih.gov/pubmed/23128249
- Xiong X, Wu T, He S. Physical forces make rete ridges in oral mucosa. Med Hypotheses. 2013;81(5):883–6.
- Izumi K, Kato H, Feinberg SE. Tissue Engineered Oral Mucosa. In: Stem Cell Biology and Tissue Engineering in Dental Sciences [Internet]. Elsevier; 2015 [cited 2016 Jul 10]. p. 721–31. Available from: http://linkinghub.elsevier.com/retrieve/pii/B9780123971579000771
- Tra WMW, Spiegelberg L, Tuk B, Hovius SER, Perez-Amodio S. Hyperbaric oxygen treatment of tissue-engineered mucosa enhances secretion of angiogenic factors in vitro. Tissue Eng Part A [Internet]. 2014 May [cited 2016 Jun 22];20(9-10):1523–30. Available from: http://www.ncbi.nlm.nih.gov/pubmed/24320751
- Perez-Amodio S, Tra WMW, Rakhorst HA, Hovius SER, van Neck JW. Hypoxia preconditioning of tissue-engineered mucosa enhances its angiogenic capacity in vitro. Tissue Eng Part A [Internet]. 2011 Jun [cited 2016 Jun 17];17(11-12):1583–93. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21303226
- Bayar GR, Kuo S, Marcelo CL, Feinberg SE. In Vitro Development of a Mucocutaneous Junction for Lip Reconstruction. J Oral Maxillofac Surg [Internet]. 2016 Apr 13 [cited 2016 Jun 18]; Available from: http://www.ncbi.nlm.nih.gov/pubmed/27160362
- Peña I, Junquera LM, Llorente S, De Villalaín L, De Vicente JC, Llames S. Clinical outcomes after the use of complete autologous oral mucosa equivalents: Preliminary cases. Oral Surg Oral Med Oral Pathol Oral Radiol [Internet]. Elsevier; 2012;113(5):e4–11. Available from: http://dx.doi.org/10.1016/j.tripleo.2011.07.030
- Izumi K, Neiva RF, Feinberg SE. Intraoral grafting of tissue-engineered human oral mucosa. Int J Oral Maxillofac Implants [Internet]. 2014;28(5):e295–303. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=4193471&tool=pmcentrez&rendertype=abstract
- Almela T, Brook IM, Moharamzadeh K. Development of three-dimensional tissue engineered bone-oral mucosal composite models. J Mater Sci Mater Med [Internet]. 2016 Apr [cited 2016 Jun 17];27(4):65. Available from: http://www.ncbi.nlm.nih.gov/pubmed/26883949
- Amemiya T, Nakamura T, Yamamoto T, Kinoshita S, Kanamura N. Immunohistochemical study of oral epithelial sheets cultured on amniotic membrane for oral mucosal reconstruction. Biomed Mater Eng [Internet]. 2010 [cited 2016 Jun 30];20(1):37–45. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20448302
- Rouabhia M, Allaire P. Gingival mucosa regeneration in athymic mice using in vitro engineered human oral mucosa. Biomaterials [Internet]. Elsevier Ltd; 2010;31(22):5798–804. Available from: http://dx.doi.org/10.1016/j.biomaterials.2010.04.004
- Peña I, Junquera LM, Meana Á, García E, Aguilar C, Fresno MF. In vivo behavior of complete human oral mucosa equivalents: characterization in athymic mice. J Periodontal Res [Internet]. 2011 Apr [cited 2016 Jun 27];46(2):214–20. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21348871
- Ayvazyan A, Morimoto N, Kanda N, Takemoto S, Kawai K, Sakamoto Y, et al. Collagen-gelatin scaffold impregnated with bFGF accelerates palatal wound healing of palatal mucosa in dogs. J Surg Res [Internet]. Elsevier Inc; 2011;171(2):e247–57. Available from: http://dx.doi.org/10.1016/j.jss.2011.06.059
- Kinikoglu B, Hemar J, Hasirci V, Breton P, Damour O. Feasibility of a porcine oral mucosa equivalent: a preclinical study. Artif Cells Blood Substit Immobil Biotechnol [Internet]. 2012 Aug [cited 2016 Jun 27];40(4):271–4. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22309108
- Qi F, Yoshida T, Koike T, Aizawa H, Shimane T, Li Y, et al. Construction and characterization of human oral mucosa equivalent using hyper-dry amniotic membrane as a matrix. Arch Oral Biol [Internet]. Elsevier Ltd; 2016;65:26–34. Available from: http://dx.doi.org/10.1016/j.archoralbio.2016.01.011
INFORMACIÓN DEL ARTÍCULO
Autora para la correspondencia: Juliana Girón Bastidas. Teléfono: 57 (1) 3195849707. Bogotá-Colombia. jgironb@correo.ugr.es