Original
Generación y caracterización de un modelo lesional corneal ex vivo para su uso en ingeniería tisular
Generation and characterization of an in vivo model of corneal lesion for use in tissue engineering
Actual. Med. 2016; 101: (797): 7-12 DOI: 10.15568/am.2016.797.or01
Enviado: 21-11-2015
Revisado: 20-01-2016
Aceptado: 23-02-2016
RESUMEN
Objetivos: En el presente estudio se pretende generar y caracterizar un modelo lesional corneal ex vivo, con el fin de poder evaluar la viabilidad de los tejidos artificiales creados mediante Ingeniería Tisular a través de la aplicación de una causticación controlada con NaOH sobre córneas de cerdo.
Métodos: Se llevó a cabo un estudio descriptivo tomando 18 ojos de cerdos adultos, inmediatamente después de morir. Los globos oculares se introdujeron en NaOH 1,5 M durante 1, 2, 3 y 5 minutos. Tras lo cual se lavaron con agua corriente (5 minutos) y se realizó un lavado rápido con PBS, seguido de un lavado de 2 minutos en PBS. Se incluyeron dos grupos control: uno de córneas no tratadas, y otro de córneas a las que se les realizó lavados de agua corriente y PBS. Las muestras fueron procesadas para el análisis histológico mediante microscopía óptica con las tinciones de hematoxilina eosina, picrosirius y azul alcian. Se determinó la significación de los resultados obtenidos mediante el análisis estadístico ANOVA.
Resultados: Se observó una pérdida del endotelio y del epitelio corneal en todos los grupos tratados con NaOH. Asimismo se objetivó una tendencia a la compactación de las fibras colágenas tras el tratamiento con NaOH en la tinción de picrosirius y la pérdida de fibras de coloración verde en las muestras tratadas con NaOH con respecto a los controles. Pese a observarse una menor intensidad en la tinción de azul alcian en la región posterior con respecto a las otras dos y entre las distintas muestras tratadas con NaOH, no se encontraron diferencias significativas en este aspecto.
Conclusiones: se ha logrado crear un modelo lesional sencillo, de bajo coste y que no implica problemas éticos, que permitiría evaluar los tejidos artificiales creados mediante Ingeniería Tisular.
Palabras clave: Ingeniería tisular; córnea artificial; causticación, modelo lesional, modelo ex vivo
ABSTRACT
Purpose: This study aims to generate and characterize an ex vivo corneal injury model, in order to assess the feasibility of artificial tissues created by using tissue engineering through the application of a corneal alkali burn with NaOH on porcine corneas.
Methods: We conducted a descriptive study taking 18 eyes of adult pigs immediately after their death. Eyes were introduced on 1.5M NaOH for 1, 2, 3 and 5 minutes. After, they were washed with running water (5 min) and rapid washing with PBS, followed by a 2 minute wash in PBS was performed. Two control groups were included: untreated corneas and another corneas were performed running water washes and PBS whashes. Samples were processed for histological analysis by light microscopy with hematoxylin and eosin, alcian blue and picrosirius staining. The significance of the results was determined by ANOVA statistical analysis.
Results: We observed a loss of endothelium and the corneal epithelium in all groups treated with NaOH. A tendency to compaction of collagen fibers after treatment with NaOH and picrosirius stain loss of green coloration fibers in samples treated with NaOH with respect to controls was also observed. Despite lower intensity observed in alcian blue staining in the posterior region compared to the other two and between samples treated with NaOH, no significant differences were found in this area.
Conclusions: it has created a single lesion model, low cost and does not involve ethical issues, to assess the tissue created by Tissue Engineering.
Keywords: Tissue engineering; artificial cornea; caustic burn, injury model, ex vivo model.
Leer Artículo Completo
INTRODUCCIÓN
Las enfermedades que afectan a la córnea son una de las principales causas de ceguera en el mundo, situándose entre las tres más prevalentes a nivel mundial (1). Actualmente los únicos tratamientos disponibles son la queratoplastia o trasplante de córnea mediante un injerto de donante, y la queratoprótesis (2). El acceso a ambos tratamientos en los países donde más se precisan es muy limitado por la falta de donantes y medios sanitarios (3). Además, en relación con el trasplante de córnea, existe una baja supervivencia del injerto. Esto se debe a la alta probabilidad de rechazo inmunológico asociada a la neovascularizacion e insuficiencia limbar que presentan la mayoría de los pacientes con ceguera corneal (4).
En relación a este contexto, la Ingeniería Tisular emerge con el objetivo de dar respuesta a la ausencia de una terapia eficaz para estos pacientes mediante la creación de tejidos artificiales que reemplacen la córnea dañada del paciente. Existen múltiples propuestas de sustitutos para la córnea, realizadas a partir de diversos biomateriales como la fibrina (5), la fibrina agarosa (6), el colágeno (7), la seda (8), o las córneas descelularizadas (9). Los sustitutos corneales han de biointegrarse con la zona dañada de la córnea nativa del paciente para conseguir una unión perfecta con el tejido receptor. Dicha región, se caracteriza generalmente por una reacción de fibrosis donde los queratocitos cambian su fenotipo para convertirse en fibroblastos corneales o en miofibroblastos (10). De este modo, se hace necesario realizar una evaluación óptima en la fase preclínica de la integración de las córneas artificiales en un órgano previamente dañado.
La evaluación de un sustituto corneal sobre una córnea previamente dañada se puede realizar usando modelos lesionales previamente caracterizados. Idealmente, dichos modelos han de mimetizar las condiciones patológicas que se encuentran en las córneas de los pacientes que precisan estos tratamientos, como son: la desestructuración del estroma corneal asociando una reacción de fibrosis, así como una pérdida de transparencia. Hasta la fecha, sólo se han descrito modelos lesionales corneales in vivo basados la mayoría en quemaduras alcalinas infligidas sobre animales de experimentación (11,12).
Ante los inconvenientes tanto éticos como materiales que subyacen al uso de modelos in vivo, es preciso encontrar nuevos modelos lesionales corneales que puedan emplearse en el laboratorio sin la necesidad de usar animales de experimentación. El objetivo de nuestro estudio es generar y caracterizar un modelo lesional corneal ex vivo para la evaluación de tejidos artificiales creados por Ingeniería Tisular mediante la aplicación de una quemadura caústica sobre córneas porcinas.
MATERIAL Y MÉTODOS
Obtención de córneas y proceso de causticación:
Se obtuvieron 18 ojos de cerdos adultos de un matadero local, inmediatamente después de su muerte. Tras ello, se realizó un proceso de causticación con NaOH 1,5 M a tiempos crecientes (1, 2, 3 y 5 minutos) sobre los globos oculares completos (n=3). A continuación, se realizó un lavado con agua corriente continua durante 5 minutos, seguido de una inmersión rápida en PBS, para continuar con un nuevo lavado en PBS de 2 minutos. Posteriormente, se trepanaron los 8mm centrales corneales usando un punch de 8mm (Integra® Miltex®) para su evaluación histológica. Se incluyeron dos grupos control para su comparación con los anteriores (n=3): córneas no tratadas, trepanadas directamente tras la extracción del globo ocular y córneas sólo tratadas con los lavados de agua corriente y PBS sin inmersión en NaOH.
Evaluación histológica:
Las muestras fueron fijadas en formaldehído al 4%, se deshidrataron en una serie de etanol, tras lo cual se incluyeron en parafina. Las secciones transversales fueron cortadas, a 5 micras de espesor, se tiñeron con tinciones de: Hematoxilina y Eosina (HE), PicroSirius y Azul Alcian. En primer lugar, la parafina fue retirada de los cortes de tejido empleando xileno. Posteriormente la muestra se rehidrató con agua a través de una serie decreciente de alcoholes (100%, 96%, 70%, 50%, y agua). Tras este proceso se realizaron las diferentes tinciones.
Para evaluar el patrón de tejido con el fin de reconocer los núcleos de las células, el material citoplásmico, la membrana celular y algunas estructuras extracelulares, se realizó una tinción con HE. Para evaluar la presencia de fibras de colágeno, el componente mayoritario del estroma corneal, se realizó tinción Picrosirius Red usando solución Sirius F3B roja durante 30 minutos, que se contrastó con hematoxilina de Harris durante 5 minutos, usando para su visualización microscopía de luz polarizada. Para determinar el contenido de proteoglicanos, componente fundamental para la organización característica de las fibras de colágeno en el estroma corneal, las muestras se incubaron en solución de azul Alcian durante 30 minutos y se contrastaron con solución de rojo nuclear rápido durante 1 minuto.
Las imágenes histológicas se tomaron con un microscopio óptico empleando las mismas condiciones para todos los grupos (tiempo de exposición, balance de blancos, fondo, etc.) a diferentes aumentos (4x, 10x y 20x). Posteriormente, para cuantificar los daños producidos en el tejido corneal, las muestras se analizaron cuantitativamente utilizando el software de análisis de imagen ImageJ. Se analizaron de forma independiente tres regiones diferentes del estroma corneal de cada muestra, correspondiente a la región anterior, la región media y la región posterior de cada córnea, tomando para ello una selección rectangular del mismo área para las tres regiones analizadas.
Para cuantificar la intensidad de la tinción específica de cada componente de la matriz extracelular (ECM), tanto de las muestras como de los controles, se usó el software de análisis de imagen ImageJ. Con cada una de las regiones seleccionadas (anterior, media y posterior) de las imágenes captadas con el aumento de 10x, se llevó a cabo el mismo procedimiento: se seleccionó el color de interés que deseábamos analizar (para seleccionar el azul alcian y el rojo picrosirius se usó la función Color Function- Color deconvolution, y para seleccionar el verde se usó la función Color Split Channel), se pasó la imagen a 8 bits y después se invirtieron los colores de la imagen mediante el comando Invert. Tras esto, se seleccionó el área rectangular y se cuantificó la intensidad media de los pixels de la imagen mediante el uso de la función Analyze/Measure del software ImageJ.
Para evaluar el grado de compactación estromal, se tomó en cuenta el grado de separación de las fibras colágenas en la tinción de Picrosirius. Todo ello se calculó mediante el programa ImageJ, tras seleccionar las regiones anterior, media y posterior. Para ello, se seleccionó el canal rojo y se convirtió la imagen a binario, se invirtieron los canales y se analizó posteriormente mediante un histograma la cantidad de pixels de intensidad 0 (color máximo negro, correspondiente al colágeno) y de intensidad 255 (color máximo blanco, correspondiente al espacio vacío entre fibras). El grado de separación de las fibras colágenas se calculó dividiendo el número de pixels blancos entre los pixels negros.
Análisis estadístico:
El análisis estádistico se realizó usando ANOVA con normalización de Bonferroni para el análisis de las diferencias entre los diferentes grupos para cada región corneal evaluada. Para la comparación entre los dos grupos controles utilizados en el estudio, se realizó la prueba T-Test. Para la evaluación entre las regiones dentro de cada grupo, se usó T-Test con corrección de Bonferroni. Para el análisis estadísticos ANOVA, se usó el software estadístico Stata/SE 12.0. Para el resto de análisis, se empleó el software Excel 2010. p<0.05 se consideró como significativo en todos los tests realizados.
RESULTADOS:
Evaluación histológica
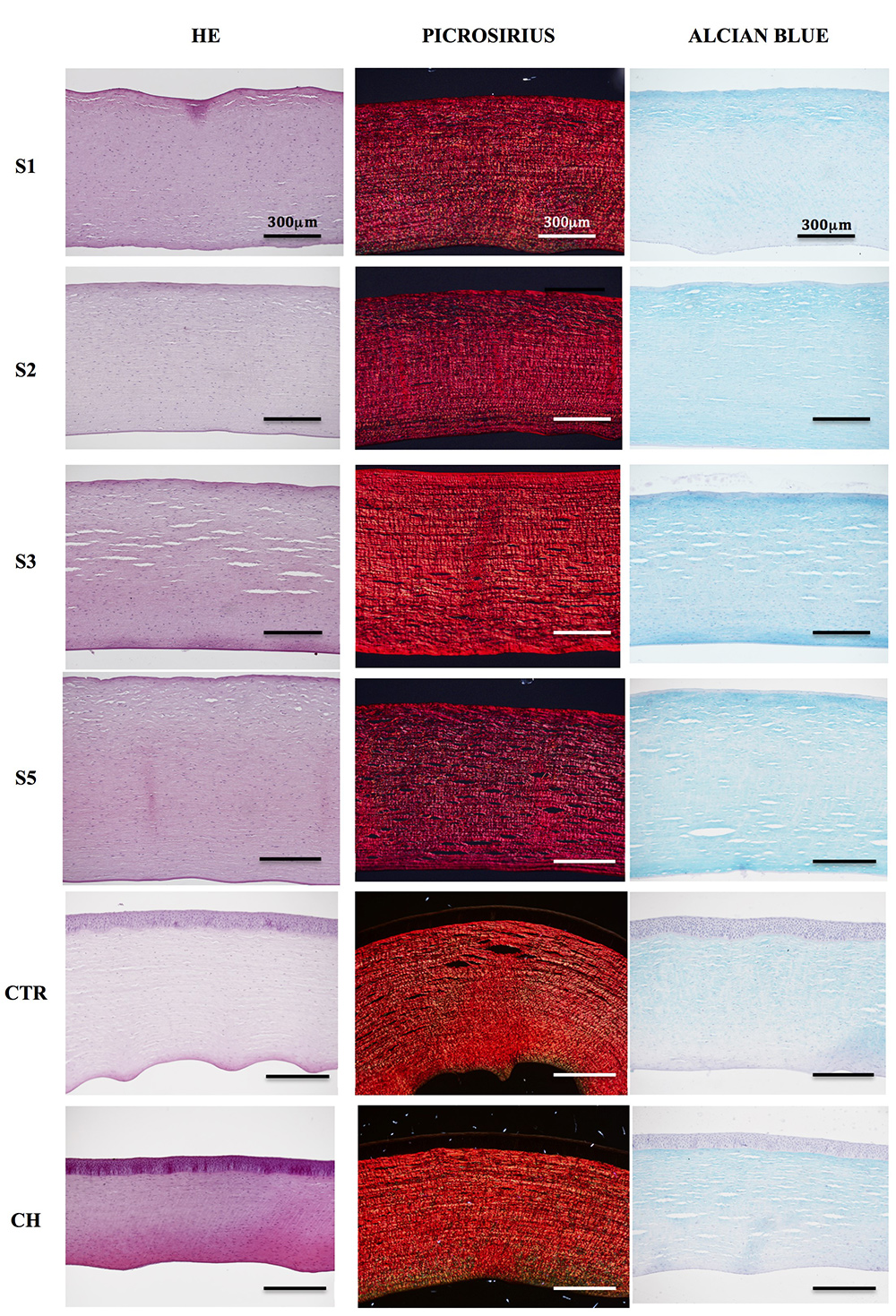
La tinción con HE (Figura 1) mostró la ausencia de epitelio y endotelio corneal en los cuatro grupos tratados con NaOH. No se observaron alteraciones evidentes, tanto a nivel estromal entre las muestras tratadas con NaOH y los controles, siendo el componente celular como extracelular similares entre los grupos.
Figura 1. Análisis histológico con hematoxilina y eosina (HE), picrosirius y azul alcian. Primera fila: córneas en NaOH 1 minuto; segunda fila: córneas en NaOH 2 minutos; tercera fila: córneas en NaOH 3 minutos; cuarta fila: córneas en NaOH 5 minutos; quinta fila: control de córnea; sexta fila: control hidratado de córnea. Escala: 300 micras.
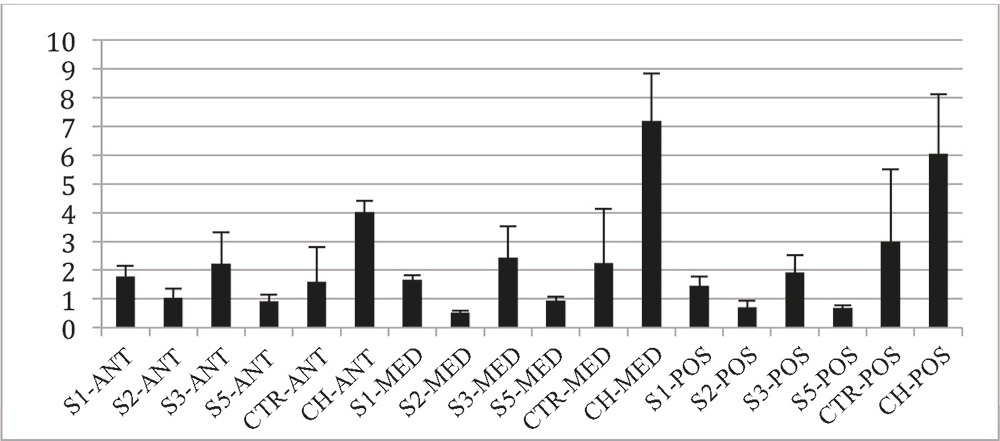
La evaluación mediante tinción de Picrosirius (Figura 1) reveló la existencia de un patrón de separación de las fibras colágenas con una tendencia a la compactación de las fibras tras el tratamiento con NaOH (Figura 2). Se observó una mayor separación de fibras en los controles hidratados respecto al resto de grupos, siendo estadísticamente significativo en los grupos de las regiones medias y posteriores.
Figura 2. Grado de separación de fibras colágenas de la córnea observado en la tinción de picrosirius. S1: córneas en NaOH 1 minuto; S2: córneas en NaOH 2 minutos; S3: córneas en NaOH 3 minutos; S5: córneas en NaOH 5 minutos; CTR: control de córnea; CH: control hidratado de córnea. ANT: área anterior; MED: área intermedia; POS: área posterior.
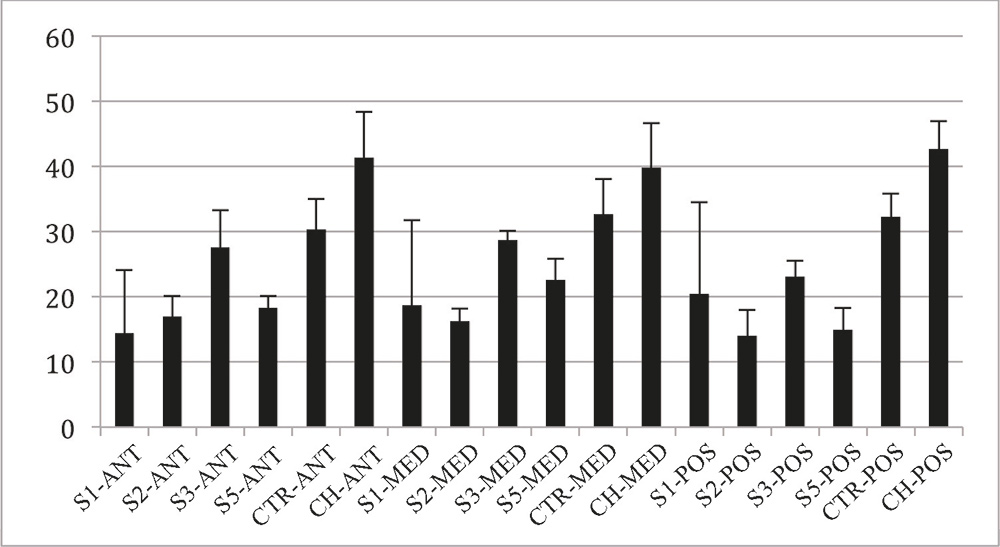
En relación con las diferencias de intensidad de rojo, no se observó ninguna diferencia estadísticamente significativa entre los distintos grupos evaluados, no existiendo tampoco diferencias regionales dentro de los mismos (p>0.05). Sin embargo, la evaluación de la intensidad de verde en la tinción de Picrosirius, reveló diferencias estadísticamente significativas entre el control hidratado y las muestras tratadas con NaOH durante 1, 2 y 5 minutos tanto para la región anterior como para la posterior (p<0.05) (Figura 3).En la región intermedia, sólo los tiempos de 1 y 2 minutos fueron diferentes al control hidratado significativamente (p<0.05). No hubo diferencias significativas entre los controles no hidratados e hidratados, ni tampoco entre el resto de grupos (p>0.05). Sin embargo, se observó una tendencia a la pérdida de verdes de las muestras tratadas con NaOH respecto de los controles. En relación con las muestras tratadas con NaOH, se apreció una tendencia irregular en los cambios de intensidad del verde, presentando una disminución a los 2 minutos respecto al tiempo de 1 minuto, para ascender nuevamente a los 3 minutos y volver a caer a los 5 minutos (Figura 3).
Figura 3. Intensidad de las fibras verdes observadas en la tinción de picrosirius tras el tratamiento con NaOH. S1: córneas en NaOH 1 minuto; S2: córneas en NaOH 2 minutos; S3: córneas en NaOH 3 minutos; S5: córneas en NaOH 5 minutos; CTR: control de córnea; CH: control hidratado de córnea. ANT: área anterior; MED: área intermedia; POS: área posterior.
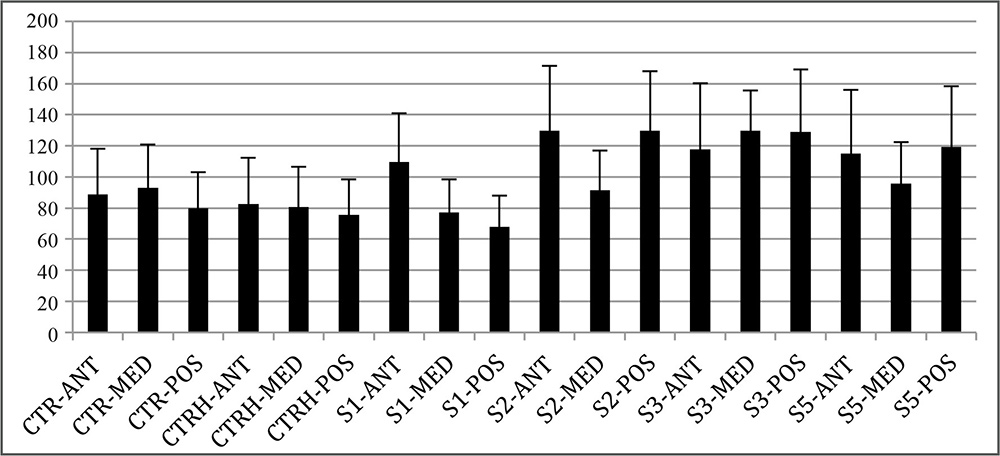
La evaluación de proteoglicanos mediante la tinción Alcian Blue (Figura 1) reveló que no existen diferencias estadísticamente significativas entre los controles no hidratados y los hidratados (p>0.05) (Figura 4). En relación con las diferentes regiones analizadas en los controles, no existieron diferencias significativas entre éstas aun cuando se observa una menor intensidad en la región posterior respecto a las dos regiones más superficiales analizadas. A pesar de las diferencias observadas entre las distintas concentraciones de NaOH en relación con la intensidad de tinción mostrada por las distintas áreas, sólo se observaron diferencias estadísticamente significativas en la región anterior del grupo tratado durante 2 minutos con NaOH frente al grupo de controles hidratados (p<0.05), mostrando una mayor intensidad las muestras tratadas con NaOH (Figura 4).
Figura 4. Intensidad de azul en la tinción de azul alcian tras el tratamiento de las córneas con NaOH. S1: córneas en NaOH 1 minuto; S2: córneas en NaOH 2 minutos; S3: córneas en NaOH 3 minutos; S5: córneas en NaOH 5 minutos; CTR: control de córnea; CH: control hidratado de córnea. ANT: área anterior; MED: área intermedia; POS: área posterior.
DISCUSIÓN:
En este trabajo hemos logrado generar y caracterizar un modelo lesional corneal a través de la causticación de córneas provenientes de cerdos. Dicho modelo facilitaría evaluar los tejidos artificiales creados mediante Ingeniería Tisular sin la necesidad de emplear para ello animales de experimentación.
La caracterización del modelo se llevó a cabo a través de una evaluación histológica mediante diversas tinciones. En primer lugar pudimos observar cómo el epitelio y el endotelio se pierden en su totalidad tras la aplicación de NaOH, independientemente del tiempo aplicado. Además, la tinción de Picrosirius reveló la existencia de un patrón de separación de las fibras colágenas con una tendencia a la compactación de las fibras tras el tratamiento con NaOH.
En relación con las variaciones en la composición estromal evaluadas con la medición de intensidades de las distintas tinciones empleadas, no se observaron alteraciones evidentes en la mayoría de los grupos tras la aplicación de NaOH. Este hecho puede deberse posiblemente a que el colágeno y los proteoglicanos soportan en gran medida la acción de los agentes químicos (13). Sí pudimos observar ciertas tendencias de daño tisular que no demostraron significación estadística como la pérdida de verdes de las muestras tratadas con NaOH respecto de los controles. Dicha pérdida de intensidad de verde podría asociarse a una alteración de los distintos tipos de colágenos que existen en la córnea o al grado de compactación de fibras, ya que existe una controversia en relación con el verde en la tinción de picrosirius que lo asocia a ambos aspectos (14,15,16). No obstante, el número de muestras empleados era muy bajo, por lo que la potencia estadística era muy limitada.
Se han empleado con anterioridad otros modelos lesionales de córnea mediante causticación alcalina con NaOH para evaluar una gran variedad de elementos: expresión de diversas proteínas (17), mejora de la cicatrización mediante el bloqueo de receptores (18,19), aceleración de la cicatrización mediante células madre mesenquimales (20,21,22), evaluación de medicamentos (23, 24, 25, 26) o neovascularización (27), etc. Todos ellos se han realizado en modelos in vivo, lo cual implica grandes limitaciones éticas y materiales para su realización, a excepción de uno de ellos, en el que se llevó a cabo la evaluación de medicamentos en un modelo ex-vivo bovino (26).
En Ingeniería Tisular, la evaluación de constructos para la regeneración corneal suele realizarse en modelos in vivo que no asocian lesión. Sólo en algunos casos se han empleado modelos lesionales in vivo creados a partir de quemaduras alcalinas11 12 . Al tratarse de modelos in vivo, asocian las mismas barreras que los anteriores. Por ello, la existencia de un modelo ex vivo lesional que pueda utilizarse en el laboratorio sin ningún tipo de barrera ética o material, puede suponer un avance significativo en la Ingeniería Tisular de la córnea. La importancia de nuestro modelo radica en su fácil empleo para la evaluación de tejidos artificiales y la posibilidad de valorar cómo se integran dichos tejidos en un ambiente tisular dañado.
Además, nuestro modelo lesional podría ser empleado para la evaluación de la farmacodinámica y otros cambios histológicos o fisiológicos en pacientes con patología corneal similar a la provocada por la quemadura alcalina en nuestro modelo lesional.
En relación con el modelo aquí descrito, existen diversas limitaciones en las cuales continuamos trabajando. Por un lado, es necesario comparar nuestro modelo con lo que ocurre en la córnea humana normal tras dañarse con NaOH. Esto conlleva una seria de limitaciones difíciles de franquear. Por un lado, la falta de córneas humanas para experimentación, ya que la mayoría se usan para trasplantes corneales en clínica. Por otro lado, existiría la posibilidad de usar muestras de anatomía patológica obtenidas tras realizar un trasplante corneal en pacientes que han sufrido una causticación. Sin embargo, el número de muestras existentes en nuestro medio es muy bajo y además, presentan un daño tisular crónico, siendo imposible evaluar el daño agudo asociado a la exposición a NaOH como presentamos en nuestro modelo. La realización de un modelo ex vivo que presente daño crónico implicaría mantener las córneas en tratamiento durante largos periodos de tiempo, lo cual conllevaría una gran dificultad y un alto coste. Además, hemos de tener en cuenta que al ser un modelo ex vivo estamos excluyendo la reacción sistémica al daño ejercido ya que no existe sistema inmune o vascularización en este modelo.
En el futuro, y teniendo en cuenta los grandes avances en la Ingeniería Tisular, los constructos corneales y las queratoprótesis podrían representar una nueva alternativa a los donantes humanos de córnea. Por lo tanto, necesitamos modelos corneales donde estos constructos puedan evaluarse de forma óptima. De este modo, si conocemos los diferentes cambios que se producen en la córnea lesionada y su correspondencia con el modelo lesional propuesto, nos permitiría seleccionar el más apropiado para cada caso. Por otra parte, no podemos olvidar el posible uso del modelo ex vivo aquí descrito para la evaluación de fármacos y la posibilidad de evaluar la fisiopatología de la fibrosis corneal.
CONCLUSIÓN
En conclusión, el modelo corneal aquí descrito aporta un modelo lesional para la evaluación de constructos corneales generados por Ingeniería Tisular, el cual es sencillo y de bajo coste, no asociando ningún tipo de barrera ética. Sin embargo, la generación del modelo ha de mejorarse con el aumento del número de muestras y la realización de otro tipo de estudios sobre el mismo, como la evaluación óptica.
AGRADECIMIENTOS
Beca de Iniciación a la Investigación de la Universidad de Granada.
REFERENCIAS BIBLIOGRÁFICAS
- International Agency for the Prevention of Blindness (IAPB). Informe 2010.
- Klufas MA, Colby KA. The boston keratoprosthesis. International Ophthalmology Clinics. 2010;50(3):161–175.John P. Whitcher JP, Srinivasan
- M, Upadhyay MP. Corneal blindness: a global perspective. Bulletin of the World Health Organization, 2001, 79: 214- 221.
- Garralda A, Epelde A, Iturralde E et al. Cornea transplant. An. Sist. Sanit. Navar. 2006;29, (2) .
- Cardona Jde L, Ionescu AM, Gomez-Sotomayor R, et al. Transparency in a fibrin and fibrin-agarose corneal stroma substitute generated by tissue engineering. Cornea 2011;30:1428-1435.
- Gonzalez-Andrades M, Garzon I, Gascon MI, et al. Sequential development of intercellular junctions in bioengineered human corneas. J Tissue Eng Regen Med 2009;3:442-449.
- Mi S, Connon CJ. The formation of a tissue-engineered cornea using plastically compressed collagen scaffolds and limbal stem cells. Methods Mol Biol 2013;1014:143-155.
- Lawrence BD, Marchant JK, Pindrus MA, Omenetto FG, Kaplan DL. Silk film biomaterials for cornea tissue engineering. Biomaterials 2009;30:1299-1308.
- Gonzalez-Andrades M, de la Cruz Cardona J, Ionescu AM, Campos A, Del Mar Perez M, Alaminos M. Generation of bioengineered corneas with decellularized xenografts and human keratocytes. Invest Ophthalmol Vis Sci 2011;52:215-222.
- Jester JV, Brown D, Pappa A, Vasiliou V. Myofibroblast differentiation modulates keratocyte crystallin protein expression, concentration, and cellular light scattering. Invest Ophthalmol Vis Sci. 2012 Feb 16;53(2):770-8.
- Luo H, Lu Y, Wu T, Zhang M, Zhang Y, Jin Y. Construction of tissue- engineered cornea composed of amniotic epithelial cells and acellular porcine cornea for treating corneal alkali burn. Biomaterials 2013 Sep;34(28):6748-59.
- Hackett JM, Lagali N, Merrett K et al. Biosynthetic corneal implants for replacement of pathologic corneal tissue: performance in a controlled rabbit alkali burn model. Invest Ophthalmol Vis Sci. 2011 Feb 3;52(2):651-7. 13.
- Reim M, Redbrake C, Schrage N. Chemical and thermal injuries of the eyes. Surgical and medical treatment based on clinical and pathophysiological findings. Arch Soc Esp Oftalmol. 2001 Feb;76(2):79-124.
- Carriel V, Garzón I, Alaminos M, Campos A. Evaluation of myelin sheath and collagen reorganization pattern in a model of peripheral nerve regeneration using an integrated histochemical approach. Histochem Cell Biol. 2011 Dec;136(6):709-17.15.
- Carriel V, Aneiros- Fernández J, Arias- Santiago S, Garzón I, Alaminos M, Campos A. A Novel Histochemical Method for a Simultaneous Staining of Melanin and Collagen Fibers. J Histochem Cytochem. 2011 Mar;59(3):270-7.
- Lattouf R, Younes R, Lutomski et al. Picrosirius Red Staining: A Useful Tool to Appraise Collagen Networks in Normal and Pathological Tissues. J Histochem Cytochem. 2014 Oct;62(10):751-8.
- Li L, Zhou D, Wang XM et al. Metalloproteinases and inhibitor on the cornea tissue in rabbit after implantation of modified titanium skirt for keratoprosthesis. Zhonghua Yan Ke Za Zhi. 2012 Jan;48(1):20-6.
- Okada Y, Shirai K, Reinach PS et al. TRPA1 is required for TGF-β signaling and its loss blocks inflammatory fibrosis in mouse corneal stroma. Lab Invest. 2014 Sep;94(9):1030-41.
- Okada Y, Reinach PS, Shirai et al. TRPV1 involvement in inflammatory tissue fibrosis in mice. Am J Pathol. 2011 Jun;178(6):2654-64.
- Yao L, Li ZR, Su WR et at. Role of mesenchymal stem cells on cornea wound healing induced by acute alkali burn. PLoS One. 2012; 7 (2): e30842.
- Jiang TS, Cai L, Ji WY et al. Reconstruction of the corneal ephitelium with induced marrow mesenchymal stem cells in rats. Mol Vis. 2010 Jul 14; 16: 1304-16.
- Yang W, Gu GZ, Song E et al. Transplantation of human limbal cells cultivated on amniotic membrane for reconstruction of rat corneal epithelium after alkali burn. Zhonghua Yan Ke Za Zhi. 2007 Feb; 43 (2): 134- 41.
- Sekundo W, Augustin AJ and Strempel I (2002) Topical allopurinol or corticosteroids and acetylcysteine in the early treatment of experimental corneal alkali burns: a pilot study. Eur J Ophthalmol 12, 366-372 10.
- Dan L, Shi-long Y, Miao-li L et al (2008) Inhibitory effect of oral doxycycline on neovascularization in a rat corneal alkali burn model of angiogenesis. Curr Eye Res 33, 653-660 11.
- Guler M, Yilmaz T, Ozercan I and Elkiran T (2009) The inhibitory effects of trastuzumab on corneal neovascularization. Am J Ophthalmol 147, 703-708.
- Bhasker S, Kislay R, Rupinder KK, Jagat KR. Evaluation of nanoformulated therapeutics in an ex- vivo bovine corneal arritation model. Toxicol in vitro. 2015 Feb 13;29(5):917-925.
- Figueroa-Ortiz LC, Martín Rodríguez O, García-Ben A et al. Neovascular growth in an experimental alkali corneal burn model. Arch Soc Esp Oftalmol. 2014 Aug;89(8):303-7.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: González- Andrades, M. Departamento de Histología, Facultad de Medicina, Universidad de Granada. Avenida de Madrid 11, E18012, Granada, Spain.
Tel: +34 958243514; fax: +34 958244034 E-mail: mgandrades@gmail.com