Revisión
Nanopartículas Magnéticas en el Diagnóstico y Tratamiento del Cáncer
Magnetic Nanoparticules in Cancer Diagnosis and Treatment
Actual. Med. 2015; 100: (796): 139-144 DOI: 10.15568/am.2015.796.re01
Enviado: 08-06-2015
Revisado:06-10-2015
Aceptado: 10-10-2015
RESUMEN
Los avances en el campo de la nanotecnología incluyen el desarrollo de nuevas nanopartículas que están siendo usadas en el en el campo de la oncología, no sólo como nuevos vehiculizadores de drogas capaces de dirigirlas a lugares específicos al mismo tiempo que disminuyen sus efectos sistémicos, sino como mediadores para generar calor localizado (hipertermia) como terapia antitumoral y para la localización y visualización de este tipo de patología. En este contexto, las nanopartículas que incorporan núcleos magnéticos confiriéndoles propiedades paramagnéticas están cobrando gran relevancia en el campo del diagnóstico tumoral y también en el del tratamiento ya sea sólo para aplicar la hipertermia o para combinarla con fenómenos de direccionamiento de drogas citotóxicas mediante la adición en la superficie de la nanopartícula de moléculas que reconocen algún tipo de biomarcador de cáncer (“targeting activo”). El principal objetivo de esta revisión es presentar los avances más relevantes en el desarrollo de nanoplataformas que incorporan núcleos magnéticos y que representan una nueva estrategia para el tratamiento y/o diagnóstico del cáncer (teragnosis) indicando los principales ensayos in vitro e in vivo y especialmente los ensayos clínicos más significativos que tiene como base esta nueva concepción terapéutica dentro del campo de la oncología.
Palabras clave: Nanopartículas magnéticas, cáncer, teragnosis, ensayos clínicos
ABSTRACT
The advances in the field of nanotechnology include the development of new nanoparticles that are being used inside oncology, not only as new drugs transporters that are able to direct them to specific locations at the same time decreasing their systemic effects, furthermore, they generate localized heat (hyperthermia) as an antitumor therapy and for the localization and visualization of this type of pathology. In this context, nanoparticles with magnetic cores that have paramagnetic properties are gaining importance in the field of tumor diagnosis and also in the treatment, either only for applying hyperthermia phenomena or to combine them with targeting phenomenom of cytotoxic drugs by the addition of molecules onto the nanoparticle surface that recognize some kind of cancer biomarker (active targeting). The main objective of this review is to show the most relevant advances in the development of nanoplatforms that have magnetic cores and are a new strategy for the cancer treatment and/or diagnosis (theragnosis) by the mention of the main in vitro and in vivo assays, specially the clinical trials most important of this new therapeutic concept inside within the field of oncology.
Keywords: Magnetic nanoparticles, cancer, theragnosis, clinical trials
Leer Artículo Completo
INTRODUCCIÓN
El cáncer es una enfermedad con un elevado impacto poblacional. Se calcula que afectará a 1 de cada 3 personas a lo largo de su vida, siendo, además, la segunda causa de mortalidad en los países desarrollados y la primera en años potenciales de vida perdidos. Aproximadamente, el 56 % de los cánceres son incurables, existiendo tasas de mortalidad a 5 años de hasta el 90-100% en ciertos tipos de tumores. Es por tanto imprescindible el desarrollo de nuevos métodos de diagnóstico y tratamiento eficaces que permitan incrementar de forma significativa la supervivencia de estos pacientes y mejorar su pobre pronóstico (1,2).
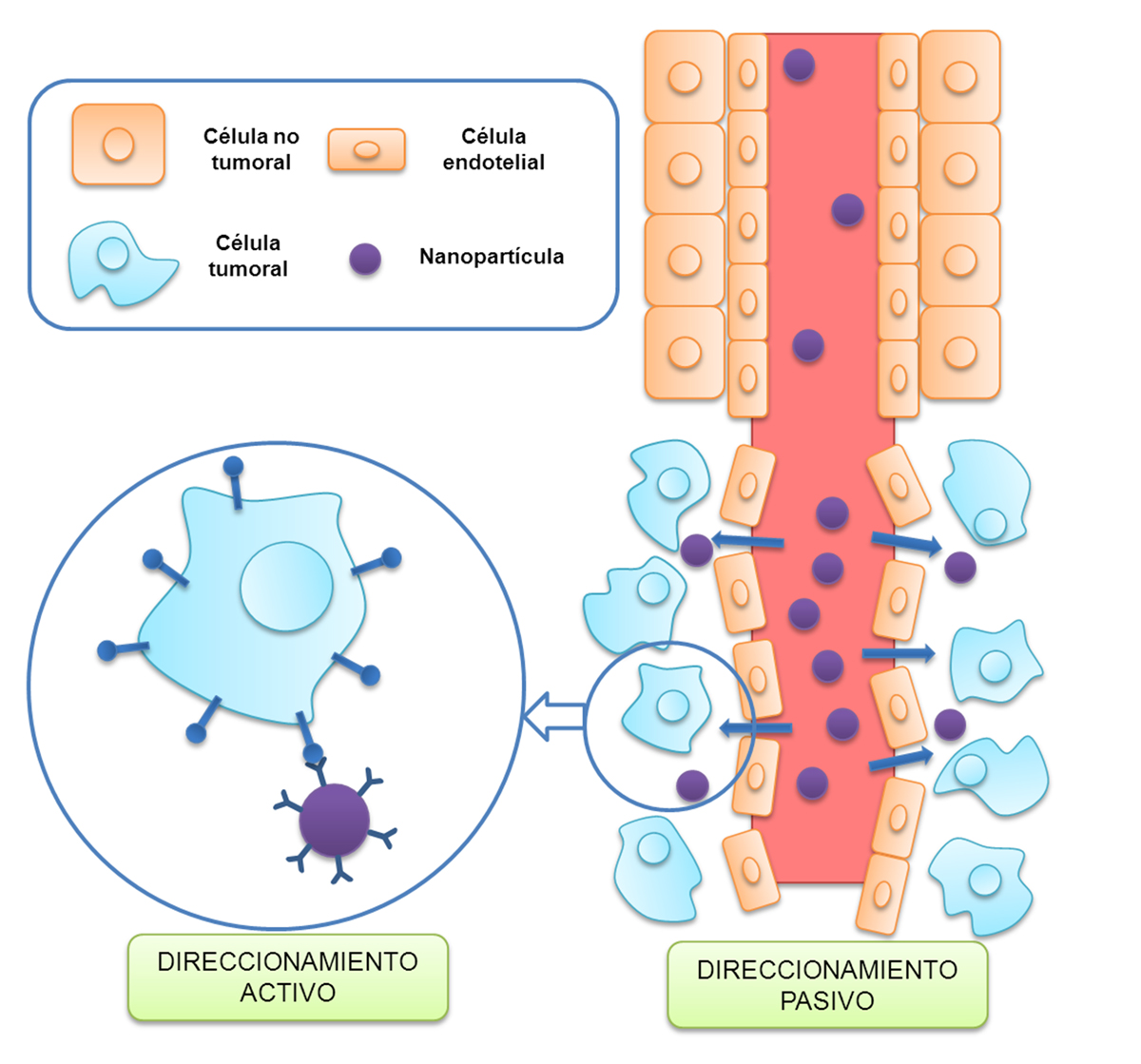
En este contexto, la nanotecnología engloba una serie de disciplinas que permiten el desarrollo, funcionalización y uso de diferentes estructuras de diámetro entre 10 y 200 nanómetros, que pueden ser usadas, entre otras muchas aplicaciones, en el campo de la oncología para mejorar el diagnóstico y tratamiento de los tumores. Las nanopartículas (NPs), las más desarrolladas y analizadas, pueden ser hidrófilas o lipofílicas. Las primeras están constituidas por polímeros (NPs poliméricas) de ácido láctico-co-glicólico (PLGA), epsilon- poli-caprolactona (PLC), chitosán o poli-butil-cianocrilato (PBCA), entre otros; las segundas (NPs sólidas lipídicas) están compuestas por lípidos sólidos como por ejemplo el tripalmitato. Aunque con características y propiedades diferentes, su diseño atiende especialmente a la capacidad para transportar de forma selectiva fármacos citotóxicos hacia las células tumorales lo que redunda en una más efectiva destrucción de dichas células y en una menor toxicidad de las drogas en los tejidos sanos, aumentando por tanto su rango de seguridad (3). Un hecho fundamental que explica esta última ventaja cuando se usan NPs, es el efecto de retención y permeabilidad aumentadas o conocido también por su siglas en inglés como efecto EPR (enhanced permeability and retention) por el que la presencia de una abundante vascularización inmadura en el tejido tumoral con grandes fenestraciones, hace que en estos tejidos se acumulen mayor cantidad de NPs que en los tejidos sanos y por tanto mayor cantidad de agentes citotóxicos. Por tanto, los fármacos citotóxicos transportados por NPs poseen mayor facilidad para alcanzar los tejidos tumorales que los mismos fármacos administrados de forma libre lo que posiblemente explica el mayor éxito de esta nueva estrategia terapéutica (4) (Figura 1).
Figura 1. Diferentes tipos de “targeting” de las NPs hacia los tumores. El “targeting” pasivo se basa en el efecto de permeabilidad y retención aumentada por el que las NPs se extravasan más fácilmente de los vasos sanguíneos de los tejidos tumorales (alta permeabilidad) que de los vasos sanguíneos de los tejidos sanos (baja permeabilidad). En el “targeting” activo, la superficie de las NPs son funcionalizadas con anticuerpos u otro tipo de ligando para que sea internalizada solo por las células diana.
Un aspecto esencial del uso de NPs en el tratamiento del cáncer es la posibilidad de poder funcionalizarlas. Existen diversos métodos para conseguir esta funcionalización, destacando aquel por el que se une a la superficie de la NP determinadas moléculas o ligandos, cuyos receptores diana se encuentran sobreexpresados en células tumorales, permitiendo así la unión específica a esos receptores presentes en estos tipos celulares y por tanto mejorando así el targeting entre ambos (Figura 1). Dentro del campo de la funcionalización se encuentra la posibilidad de incluir en el centro de la nanoplataforma, es decir, el nanotransportador de fármacos y otras moléculas, núcleos magnéticos lo que implica repercusiones específicas en cuanto al posible uso de las mismas (4). Esta modificación permite que puedan ser usadas como método de diagnóstico o también como sistema terapéutico en diversas patologías entre las que se encuentra el cáncer. Su propiedad fundamental es que, además de tener tendencia a localizarse en el tejido tumoral (“targeting pasivo”), los núcleos magnéticos permiten direccionarlas, mediante la aplicación de un campo magnético externo (imanes o generados por instrumental médico) o internos (implantados quirúrgicamente), hacia los tumores (“targeting activo”) (5). El “targeting pasivo”, responsable de que las NPs se acumulen en zonas de tejido tumoral por el fenómeno EPR, permite su aplicación diagnóstica, en donde la presencia de compuestos paramagnéticos como Fe (ya sea en forma de magnetita, Fe3O4, o de magnemita, Fe2O3) puede ser detectada por equipos de Resonancia Magnética Nuclear (RMN) con alta precisión lo que está permitiendo en muchos casos realizar un diagnóstico más precoz de tumores, especialmente de aquellos de muy pequeño tamaño, y por tanto mejorar el pronóstico de estos pacientes (6). Por otra parte, el “targeting activo” tiene una aplicación fundamentalmente terapéutica, ya que los campos magnéticos (ya sean externos e internos) potencian la acumulación de NPs funcionalizadas con núcleos magnéticos, lo que induce una mayor concentración de citotóxicos en el tejido tumoral y por tanto una mayor actividad antineoplásica (7).
Nuestro objetivo en este trabajo es hacer una revisión sobre los avances más importantes en el uso de NPs funcionalizadas con núcleos magnéticos en el tratamiento, diagnóstico y teragnosis del cáncer, destacando las principales experiencias de laboratorio en modelos in vitro e in vivo, especialmente aquellas que han tenido una traducción en la clínica a través del desarrollo de ensayos.
DIAGNÓSTICO, TRATAMIENTO Y TERAGNOSIS CON NANOPARTÍCULAS FUNCIONALIZADAS CON NÚCLEOS MAGNÉTICOS
Diagnóstico
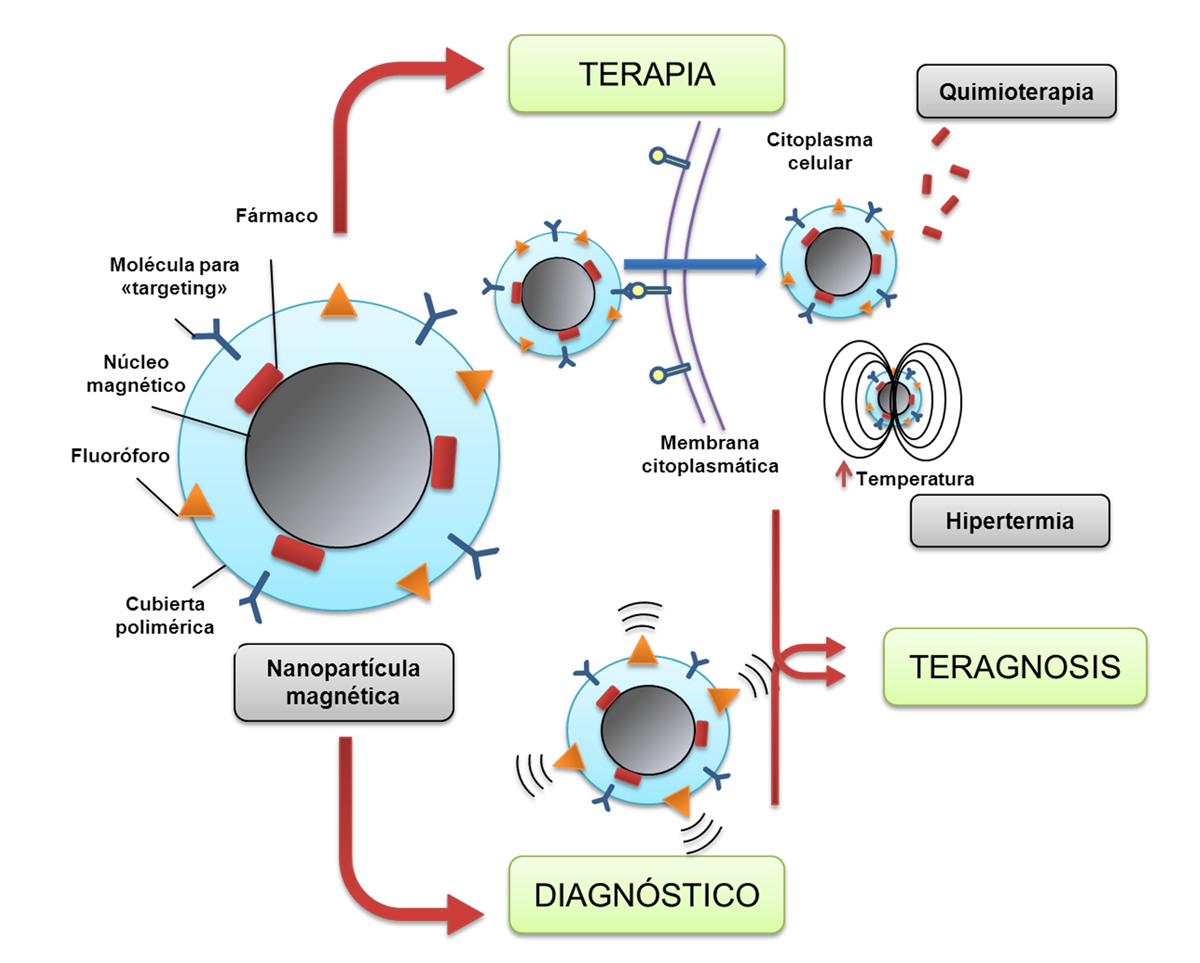
Como se ha mencionado anteriormente, las NPs tienden a localizarse en el tejido tumoral por “targeting pasivo” gracias al efecto EPR. Al tratarse de NPs funcionalizadas con núcleos magnéticos, es decir, que están formadas por un núcleo paramagnético como el hierro, pueden ser detectadas mediante técnicas de RMN, permitiendo el diagnóstico de tumores de tamaños de hasta 2-3 mm de diámetro, lo que posibilitaría su diagnóstico precoz y por consiguiente, un mejor pronóstico y supervivencia (Figura 2).
Figura 2. Composición de una NP funcionalizada con núcleos magnéticos que transporta un fármaco antitumoral y un fluoróforo y su aplicación en el diagnóstico, tratamiento y teragnosis del cáncer. El tratamiento se produce tanto por la liberación del fármaco quimioterápico dentro de la célula tumoral (quimioterapia) como por la elevación de temperatura que se produce cuando se aplica un campo magnético sobre la NP que contiene un núcleo metálico (hipertermia). La presencia de un fluoróforo en la NP funcionalizada con núcleos magnéticos hace que pueda ser detectable en un tejido diana, así como su detección mediante técnicas de imagen como RMN debido al núcleo paramagnético de la NP. La combinación de ambas, terapia y diagnosis en una misma nanoformulación se conoce como teragnosis.
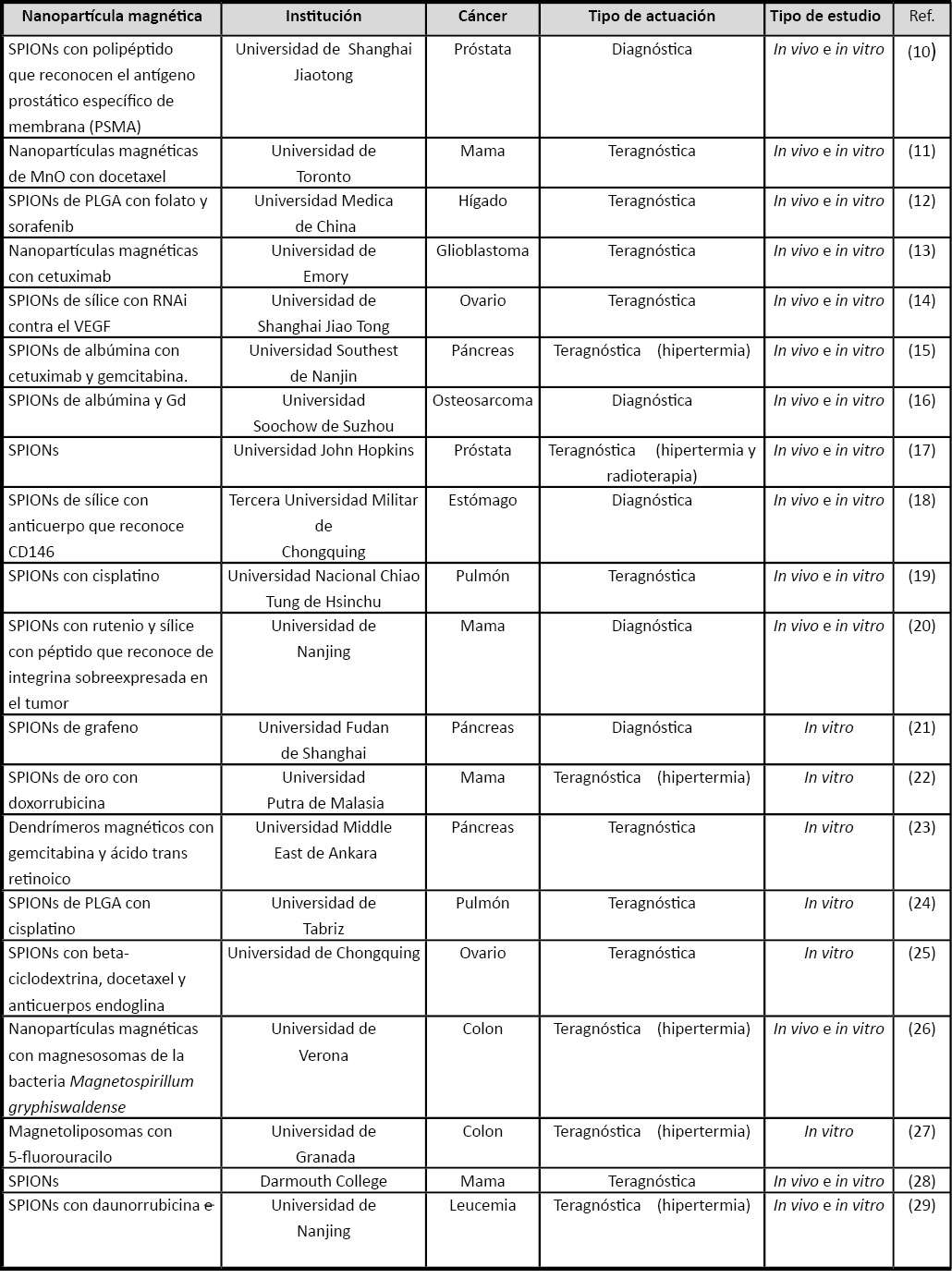
Un ejemplo son las conocidas como SPIONs (superparamagnetic iron oxide nanoparticles) (8). En la actualidad existe una variedad de SPIONs ya aprobadas para ser utilizadas en clínica con estos fines. Tal es el caso de Feridex® (en hígado), Ferumoxtran-10/Combidex® (en metástasis ganglionares), Clariscan (para detectar tumores por su microvasculatura peculiar) o Ferumoxil/Lumirem® (en intestino) (9). Asimismo, se han realizado multitud de estudios tanto in vitro como in vivo para el desarrollo de nuevas nanoplataformas funcionalizadas con núcleos magnéticos implicadas en el tratamiento del cáncer (Tabla 1). Zhu et al. (10) desarrollaron SPIONs con péptidos reconocedores del antígeno prostático específico de membrana (PSMA). Estas NPs fueron inoculadas en ratones observándose una localización selectiva en los tumores prostáticos mediante el uso de técnicas de imagen (RMN) e histológicas (tinción de Perl, azul de Prusia). Wang et al. (18) utilizaron SPIONs compuestos por sílice y funcionalizadas con anticuerpos monoclonales frente a la proteína de membrana CD146 que inocularon en ratones con tumores gástricos observando mediante RMN su fijación específica en dichos tumores (18).
Tabla 1. Estudios in vitro y/o in vivo con aplicación de nanopartículas magnéticas en el tratamiento, diagnóstico y teragnosis de diferentes tipos de cáncer.
Tratamiento
El “targeting pasivo” hace que las NPs se acumulen preferentemente en el tejido tumoral, en donde por tanto, aumenta también la concentración del citotóxico transportado (Figura 2). Las NPs funcionalizadas con núcleos magnéticos permiten además, un direccionamiento más selectivo mediante el uso de campos magnéticos externos (instrumentos médicos o imanes) o internos (imanes implantados) (“targeting activo”) (30) que aumenta la eficacia y disminuye la toxicidad inespecífica de los fármacos, mejoras terapéuticas que incidirían directamente en la supervivencia y calidad de vida de los pacientes. Kaluzova et al. (13) desarrollaron NPs funcionalizadas con núcleos magnéticos portadoras de cetuximab, un anticuerpo monoclonal frente al receptor del factor de crecimiento epidérmico (EGFR) que fueron administradas intracranealmente en ratones con tumores cerebrales inducidos (glioblastomas). La detección de estas NPs funcionalizadas con núcleos magnéticos mediante la tinción de azul de Prusia, desmostró una focalización de las mismas en el tumor, acompañado de un incremento significativo de la supervivencia de los ratones tratados.
Teragnosis
La teragnosis consiste en la combinación del diagnóstico y el tratamiento (Figura 2). Las NPs funcionalizadas con núcleos magnéticos permiten este uso ya que, por una parte, se acumulan de manera preferente en los tejidos tumorales (“targeting activo y pasivo”) y por otra, la aplicación de un campo magnético de cierta intensidad induce su vibración por dos fenómenos físicos conocidos como movimiento browniano y fluctuación de Neel. Esto ocasiona un ligero aumento de temperatura (hipertermia) en el tejido tumoral (hasta unos 41º-47º C) que es suficiente para inducir muerte de las células malignas, células especialmente sensibles a pequeños aumentos de temperatura. De esta manera, la aplicación de un campo magnético externo puede ser empleado para generar hipertermia en un tumor y provocar la destrucción del mismo de forma selectiva. Por lo tanto, una misma nanoformulación funcionalizada con núcleos magnéticos puede utilizarse para combinar el diagnóstico mediante técnicas de imagen y terapia mediante el fenómeno de la hipertermia (teragnosis). En otras modalidades de teragnosis, las técnicas de diagnóstico se combinan con el tratamiento mediante fármacos antitumorales, o incluso ambas con la hipertermia (30). Abbasi et al. (11) utilizaron NPs funcionalizadas con núcleos magnéticos fluorescentes de óxido de manganeso que transportaban docetaxel para el tratamiento in vivo (ratones inmunodeprimidos) de tumores de mama generados mediante la inoculación de la línea celular humana MDA-MB-231. Mediante técnicas de RMN, se observó que estas NPs, y por tanto el agente docetaxel, se acumulaban preferentemente en los tumores. Attaluri et al. (17) utilizaron SPIONs en combinación con radioterapia. Estas SPIONs fueron administradas a ratones con tumores prostáticos inducidos a través de la inoculación subcutánea de la línea celular humana LAPC-4. Los ratones fueron sometidos a campos magnéticos con el objetivo de que las NPs generasen hipertermia en el tumor, pudiéndose observar una disminución significativa del crecimiento tumoral respecto a los ratones no tratados con hipertermia, independientemente de la utilización de radioterapia.
ENSAYOS CLÍNICOS
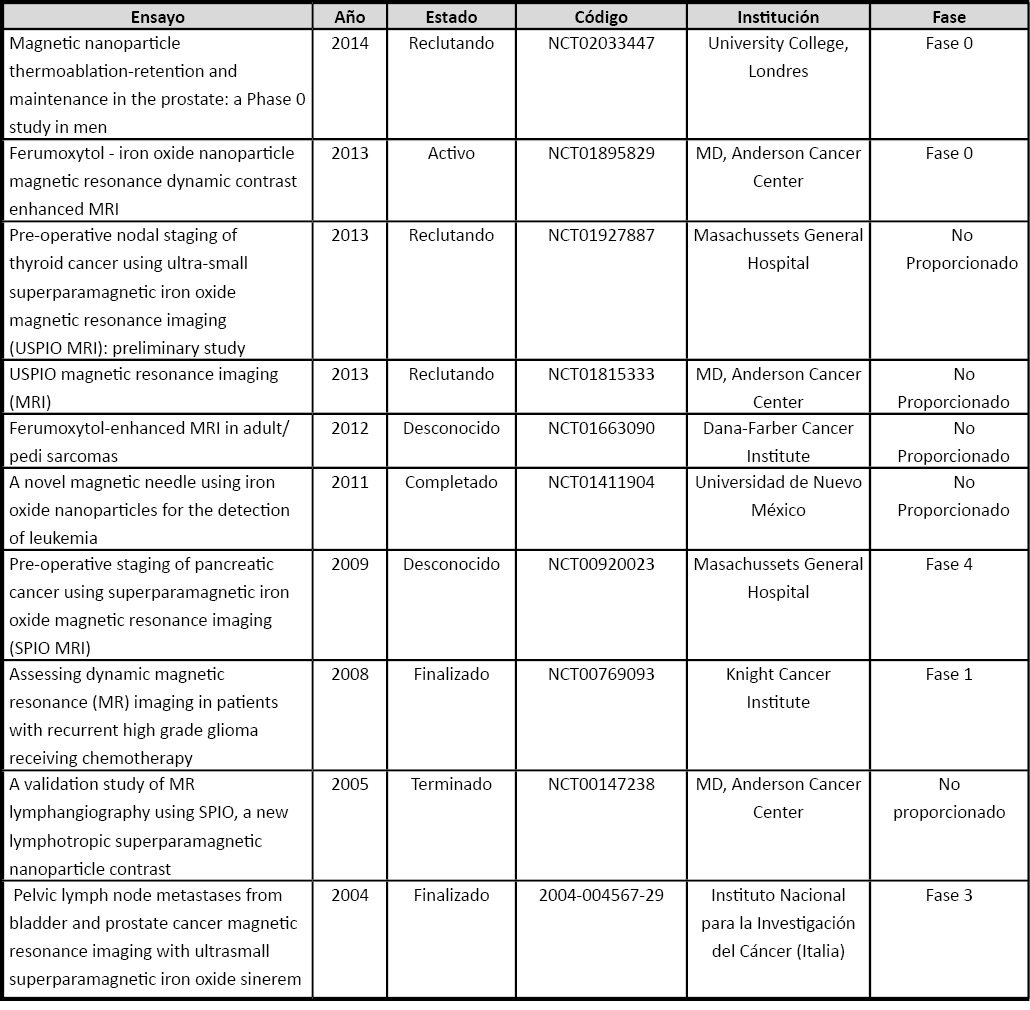
El desarrollo de NPs funcionalizadas con núcleos magnéticos y los diferentes estudios in vivo e in vitro realizados han permitido la realización de diferentes ensayos en pacientes con el objetivo de demostrar la utilidad clínica y aplicabilidad de esta tecnología. La Tabla 2 (ver página siguiente) recoge algunos de los ensayos clínicos más relevantes realizados con NPs funcionalizadas con núcleos magnéticos. Entre ellos destaca el estudio clínico previo realizado para determinar la utilidad de la termoablación magnética en pacientes con cáncer de próstata utilizando una inyección directa de NPs de hierro en el tumor (NCT02033447). En este ensayo se pretende determinar si las NPs funcionalizadas con núcleos magnéticos focalizan su acción exclusivamente en el tejido tumoral diana y no en el sano para lo que se inyectan, previo a la cistoprostatectomía radical o prostatectomía, diferentes concentraciones de NPs funcionalizadas con núcleos magnéticos en la próstata de los pacientes. El estudio incluye un análisis de la distribución anatómica de las NPs mediante la tinción de Perl (azul de Prusia) y técnicas de imagen (MRI y CT) de los tejidos extraídos tras la cirugía. El objetivo es aplicar termoablación magnética si se demuestra que las NPs permanecen en el tejido tumoral en el que han sido inyectadas. Numerosos ensayos clínicos se están realizando con Ferumoxytol y Ferumoxtran (NCT01895829, NCT01927887, NCT01815333, NCT01663090, NCT00920023, NCT00769093), primera y segunda generación, respectivamente, de NPs con núcleo de hierro que poseen cubierta de carbohidratos (31,32). Estos ensayos clínicos usan las NPs como agentes de diagnóstico precoz pero también para la evolución y seguimiento de la enfermedad, localizando las posibles metástasis que no son visibles mediante otras técnicas de imagen, y nódulos linfáticos. Recientemente, SPIONs funcionalizados con anticuerpos que reconocen CD34, han sido usados en un ensayo clínico que incluye pacientes afectos de leucemia aguda (NCT01411904). Las NPs asociadas a este biomarcador típico de leucemia aguda son incubadas con médula ósea de estos pacientes para detectar la más mínima presencia de células tumorales y de esta forma poder evaluar el estado de la enfermedad así como la posible respuesta al tratamiento. Los resultados no se encuentran disponibles aunque estudios preliminares in vitro han demostrado que las NPs funcionalizadas se unían preferentemente a células CD34 positivas aumentando hasta 10 veces la sensibilidad de dicha detección (33). Los prometedores resultados obtenidos mediante el uso de este tipo NPs hace prever que serán muchos más los ensayos clínicos que nos aportaran información sobre la utilidad real de este nuevo sistema diagnóstico-terapéutico.
Tabla 2. Principales ensayos clínicos con nanopartículas magnéticas para el diagnóstico y tratamiento del cáncer.
CONCLUSIÓN
Los estudios in vivo e in vitro realizados con NPs funcionalizadas con núcleos magnéticos y especialmente, su utilización en el desarrollo de ensayos clínicos con pacientes afectos de cáncer, indican que esta nueva estrategia está siendo ampliamente investigada y que posee un enorme interés por sus posibilidades diagnósticas y terapéuticas. El desarrollo de esta tecnología permitirá diagnosticar de una forma más precoz los tumores mejorando el pronóstico de los pacientes y realizar un tratamiento más selectivo reduciendo los efectos secundarios de la quimioterapia antitumoral actual. No obstante, serán necesarios más estudios para que esta nueva estrategia alcance su madurez y sea de aplicación habitual en la clínica.
REFERENCIAS
- Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 [Internet]. Lyon, France: International Agency for Research on Cancer; 2013 [citado 25 de mayo. 2015] http://globocan.iarc.fr.
- Bray F, Ren J-S, Masuyer E, Ferlay J. Global estimates of cancer prevalence for 27 sites in the adult population in 2008. Int J Cancer J Int Cancer. 2013;132:1133-45.
- Schmid G. Nanoparticles: From Theory to Application. Wiley-VCH Verlag GmbH & Co.:Germany; 2010.
- Maeda H. Toward a full understanding of the EPR effect in primary and metastatic tumors as well as issues related to its heterogeneity. Adv Drug Deliv Rev. 2015.
- Akbarzadeh A, Samiei M, Davaran S. Magnetic nanoparticles: preparation, physical properties, and applications in biomedicine. Nanoscale Res Lett. 2012;7:144.
- Maeda H. Tumor-selective delivery of macromolecular drugs via the EPR effect: background and future prospects. Bioconjug Chem. 2010;21:797-802.
- Widder KJ, Senyei AE, Ranney DF. Magnetically responsive microspheres and other carriers for the biophysical targeting of antitumor agents. Adv Pharmacol Chemother. 1979;16:213-71.
- Sun C, Lee JSH, Zhang M. Magnetic nanoparticles in MR imaging and drug delivery. Adv Drug Deliv Rev. 2008;60:1252-65.
- Wang Y-XJ. Superparamagnetic iron oxide based MRI contrast agents: Current status of clinical application. Quant Imaging Med Surg. 2011;1:35-40.
- Zhu Y, Sun Y, Chen Y, et al. In Vivo Molecular MRI Imaging of Prostate Cancer by Targeting PSMA with Polypeptide-Labeled Superparamagnetic Iron Oxide Nanoparticles. Int J Mol Sci. 2015;16:9573-87.
- Abbasi AZ, Prasad P, Cai P, et al. Manganese oxide and docetaxel co-loaded fluorescent polymer nanoparticles for dual modal imaging and chemotherapy of breast cancer. J Control Release Off J Control Release Soc. 2015;209:186-96.
- Li Y-J, Dong M, Kong F-M, Zhou J-P. Folate-decorated anticancer drug and magnetic nanoparticles encapsulated polymeric carrier for liver cancer therapeutics. Int J Pharm. 2015;489:83-90.
- Kaluzova M, Bouras A, Machaidze R, Hadjipanayis CG. Targeted therapy of glioblastoma stem-like cells and tumor non-stem cells using cetuximab-conjugated iron-oxide nanoparticles. Oncotarget. 2015;6:8788-806.
- Chen Y, Wang X, Liu T, et al. Highly effective antiangiogenesis via magnetic mesoporous silica-based siRNA vehicle targeting the VEGF gene for orthotopic ovarian cancer therapy. Int J Nanomedicine. 2015;10:2579-94.
- Wang L, An Y, Yuan C, et al. GEM-loaded magnetic albumin nanospheres modified with cetuximab for simultaneous targeting, magnetic resonance imaging, and double-targeted thermochemotherapy of pancreatic cancer cells. Int J Nanomedicine. 2015;10:2507-19.
- Wang Q, Lv L, Ling Z, et al. Long-circulating iodinated albumin-gadolinium nanoparticles as enhanced magnetic resonance and computed tomography imaging probes for osteosarcoma visualization. Anal Chem. 2015;87:4299-304.
- Attaluri A, Kandala SK, Wabler M, et al. Magnetic nanoparticle hyperthermia enhances radiation therapy: A study in mouse models of human prostate cancer. Int J Hyperth Off J Eur Soc Hyperthermic Oncol North Am Hyperth Group. 2015;1-16.
- Wang P, Qu Y, Li C, et al. Bio-functionalized dense-silica nanoparticles for MR/NIRF imaging of CD146 in gastric cancer. Int J Nanomedicine. 2015;10:749-63.
- Chiang C-S, Tseng Y-H, Liao B-J, Chen SY. Magnetically Targeted Nanocapsules for PAA-Cisplatin-Conjugated Cores in PVA/SPIO Shells via Surfactant-Free Emulsion for Reduced Nephrotoxicity and Enhanced Lung Cancer Therapy. Adv Healthc Mater. 2015;4:1066-75.
- Sun J, Teng Z-G, Tian Y, et al. Targeted fluorescent magnetic nanoparticles for imaging of human breast cancer. Int J Clin Exp Med. 2014;7:4747-58.
- Wang S, Zhang Q, Luo XF, et al. Magnetic graphene-based nanotheranostic agent for dual-modality mapping guided photothermal therapy in regional lymph nodal metastasis of pancreatic cancer. Biomaterials. noviembre de 2014;35:9473-83.
- Mohammad F, Yusof NA. Doxorubicin-loaded magnetic gold nanoshells for a combination therapy of hyperthermia and drug delivery. J Colloid Interface Sci. 2014;434:89-97.
- Yalçin S, Erkan M, Ünsoy G, Parsian M, Kleeff J, Gündüz U. Effect of gemcitabine and retinoic acid loaded PAMAM dendrimer-coated magnetic nanoparticles on pancreatic cancer and stellate cell lines. Biomed Pharmacother Bioméd Pharmacothérapie. 2014;68:737-43.
- Nejati-Koshki K, Mesgari M, Ebrahimi E, et al. Synthesis and in vitro study of cisplatin-loaded Fe3O4 nanoparticles modified with PLGA-PEG6000 copolymers in treatment of lung cancer. J Microencapsul. 2014;31:815-23.
- Huang X, Yi C, Fan Y, et al. Magnetic Fe₃ O ₄ nanoparticles grafted with single-chain antibody (scFv) and docetaxel loaded β-cyclodextrin potential for ovarian cancer dual-targeting therapy. Mater Sci Eng C Mater Biol Appl. 2014;42:325-32.
- Mannucci S, Ghin L, Conti G, et al. Magnetic nanoparticles from Magnetospirillum gryphiswaldense increase the efficacy of thermotherapy in a model of colon carcinoma. PloS One. 2014;9:e108959.
- Clares B, Biedma-Ortiz RA, Sáez-Fernández E, et al. Nano-engineering of 5-fluorouracil-loaded magnetoliposomes for combined hyperthermia and chemotherapy against colon cancer. Eur J Pharm Biopharm Off J Arbeitsgemeinschaft Für Pharm Verfahrenstechnik EV. 2013;85:329-38.
- Petryk AA, Giustini AJ, Gottesman RE, Trembly BS, Hoopes PJ. Comparison of magnetic nanoparticle and microwave hyperthermia cancer treatment methodology and treatment effect in a rodent breast cancer model. Int J Hyperth Off J Eur Soc Hyperthermic Oncol North Am Hyperth Group. 2013;29:819-27.
- Zhang G, Lai BB, Zhou YY, et al. Fe3O4 nanoparticles with daunorubicin induce apoptosis through caspase 8-PARP pathway and inhibit K562 leukemia cell-induced tumor growth in vivo. Nanomedicine Nanotechnol Biol Med. 2011;7:595-603.
- Singh A, Sahoo SK. Magnetic nanoparticles: a novel platform for cancer theranostics. Drug Discov Today. 2014;19:474-81.
- Yancy AD, Olzinski AR, Hu TC-C, et al. Differential uptake of ferumoxtran-10 and ferumoxytol, ultrasmall superparamagnetic iron oxide contrast agents in rabbit: critical determinants of atherosclerotic plaque labeling. J Magn Reson Imaging JMRI. 2005;21:432-42.
- Neuwelt EA, Várallyay CG, Manninger S, et al. The potential of ferumoxytol nanoparticle magnetic resonance imaging, perfusion, and angiography in central nervous system malignancy: a pilot study. Neurosurgery. 2007;60:601-11; discussion 611-2.
- Jaetao JE, Butler KS, Adolphi NL, et al. Enhanced leukemia cell detection using a novel magnetic needle and nanoparticles. Cancer Res. 2009;69:8310-6.
INFORMACIÓN DEL ARTÍCULO
Autor para la correspondencia: Jose Prados. Departamento de Anatomía y Embriología Humana. Instituto de Biopatología y Medicina Regenerativa (IBIMER). Universidad de Granada E-mail: Jcprados@ugr.es